题目内容
11.某实验小组欲制取氯酸钾,并测定其纯度.制取装置如图甲所示.请回答: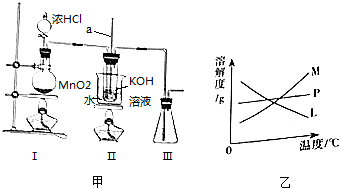
(1)Ⅱ中玻璃管a的作用为平衡压强.
(2)为了提高KOH的利用率,可将上述实验装置进行适当改进,其方法是在Ⅰ与Ⅱ之间连接盛有饱和食盐水的净化装置.
(3)反应完毕经冷却后,Ⅱ的大试管中有大量KClO3晶体析出.图乙中符合该晶体溶解度曲线的是M(填编号字母);要从Ⅱ的大试管中分离已析出晶体,下列仪器中不需要的是BDF(填仪器编号字母).
A.铁架台 B.长颈漏斗 C.烧杯 D.蒸发皿 E.玻璃棒 F.酒精灯
(4)上述制得的晶体中含少量KClO、KCl杂质.
已知:碱性条件下,ClO-有强氧化性,ClO3-很稳定;
酸性条件下,ClO-、ClO3-都具有较强的氧化性.
为测定KClO3的纯度,进行如下实验:
步骤1:去上述晶体3.00g,溶于水配成100mL溶液.
步骤2:取20.00mL溶液于锥形瓶中,调至pH=10,滴加双氧水至不再产生气泡,煮沸.
步骤3:冷却后,加入足量KI溶液,再逐渐滴加入足量稀硫酸.
发生反应:ClO3-+I-+H+→Cl++I2+H2O(未配平)
步骤4:加入指示剂,用0.5000mol•L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液48.00mL,发生反应:2S2O32-+I2═S4O62-+2I-.
①步骤2中用双氧水除去溶液中残留ClO-的离子方程式为ClO-+H2O2═H2O+Cl-+O2↑.
②该晶体中KClO3的质量分数为81.7%.
③若步骤2中未进行煮沸,则所测KClO3的质量分数偏高(填“偏低”、“偏高”或“无影响”)
分析 (1)Ⅱ中玻璃管a的作用是平衡压强,防止压强改变液体倒吸;
(2)装置Ⅰ是制备氯气的装置,生成的氯气中含有氯化氢和水蒸气,仪器进入装置Ⅱ,氯化氢也消耗氢氧化钾,需要通入前除去;
(3)在加热条件下,氯气与浓KOH溶液反应生成氯酸钾,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠,溶质的溶解度随温度的降低而降低,不溶性固体与液体的分离常采用过滤的方法;
(4)①用双氧水除去溶液中残留ClO-的反应是利用次氯酸根离子的强氧化性氧化过氧化氢生成氧气,本身被还原生成氯离子,结合原子守恒和电子守恒、电荷守恒配平书写;
②依据过程中的反应ClO3-+6I-+6H+=Cl-+3I2+3H2O和2S2O32-+I2═S4O62-+2I-,得到关系ClO3-~3I2~6S2O32-,结合实验过程中的数据计算;
③滴加双氧水至不再产生气泡,煮沸除去混有的氧气,避免氧气氧化碘离子为碘单质,消耗Na2S2O3标准溶液体积增大;
解答 解:(1))Ⅱ中玻璃管a的作用为平衡压强,防止压强改变液体倒吸,
故答案为:平衡压强;
(2)装置Ⅰ是制备氯气的装置,生成的氯气中含有氯化氢和水蒸气,仪器进入装置Ⅱ,氯化氢也消耗氢氧化钾,为了提高KOH的利用率需要通入前除去,在Ⅰ与Ⅱ之间连接盛有饱和食盐水的净化装置,除去氯化氢气体,
故答案为:在Ⅰ与Ⅱ之间连接盛有饱和食盐水的净化装置;
(3)根据题中信息可知,在加热条件下,氯气与浓KOH溶液反应生成氯酸钾,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠,二者反应的浓度和温度都不相同,反应完毕经冷却后,②的试管中有大量晶体析出,说明溶质的溶解度随温度的降低而降低,只有M符合,不溶性固体与液体的分离常采用过滤的方法,过滤需要的仪器为烧杯、铁架台、玻璃棒、漏斗等,不需要的仪器为B.长颈漏斗、D.蒸发皿、F.酒精灯,
故答案为:M,BDF;
(4)①用双氧水除去溶液中残留ClO-的反应是利用次氯酸根离子的强氧化性氧化过氧化氢生成氧气,本身被还原生成氯离子,反应的离子方程式为:ClO-+H2O2═H2O+Cl-+O2↑,
故答案为:ClO-+H2O2═H2O+Cl-+O2↑;
②反应ClO3-+6I-+6H+=Cl-+3I2+3H2O和2S2O32-+I2═S4O62-+2I-,得到关系ClO3-~3I2~6S2O32-,注意溶液体积的关系,
ClO3-~3I2~6S2O32-,
1 6
n 0.500mol/L×0.0480L×$\frac{100}{20}$
n=0.02mol
晶体中KClO3的质量分数=$\frac{0.02mol×122.5g/mol}{3.00g}$×100=81.7%,
故答案为:81.7%;
③滴加双氧水至不再产生气泡,煮沸除去混有的氧气,避免氧气氧化碘离子为碘单质,消耗Na2S2O3标准溶液体积增大,所测KClO3的质量分数偏高,
故答案为:偏高;
点评 本题考查了物质组成、物质检验、物质分离的方法、实验基本操作和反应定量的计算等知识,题目难度中等.

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案| A. | Mn02是还原剂 | B. | HCl被氧化 | ||
| C. | Mn02发生氧化反应 | D. | 4molHCl参加反应则转移4mol电子 |
| A. | MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO | B. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | ||
| C. | Na$→_{点燃}^{O_{2}}$Na2O$\stackrel{H_{2}O}{→}$NaOH | D. | Ca(OH)2$\stackrel{Cl_{2}}{→}$Ca(ClO)2$\stackrel{SO_{2}}{→}$HClO |
| A. | 常温常压下,22g由N2O于CO2组成的混合气体中含有的原子数目为1.5NA | |
| B. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| C. | 0.1mol•L-1的AlCl3溶液中含有的Cl-数目为0.3NA | |
| D. | 标准状况下,11.2L水中含有的分子数目为0.5NA |
| A. | 离子键 | B. | 共价键 | C. | 金属键 | D. | 分子间力 |
| A. | Mg2+/Mg | B. | Cl/Cl- | C. | N/O | D. | Na+/F |