题目内容
1.某学校实验室从化学试剂商店买回18.4mol•L-1的硫酸.现用该浓硫酸配制100mL 1mol•L-1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:(1)配制稀硫酸时,上述仪器中不需要使用的有②④⑥(选填序号),还缺少的仪器有100mL容量瓶、玻璃棒 (写仪器名称).
(2)配制100mL 1mol•L-1的稀硫酸需要用量筒量取上述浓硫酸的5.4mL(保留一位小数).
(3)实验中造成所配溶液浓度偏高的原因可能是B.
A.容量瓶中原来含有少量蒸馏水
B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容
C.烧杯没有洗涤
D.向容量瓶中加水定容时眼睛一直仰视刻度线.
分析 (1)根据配制溶液的实验操作过程选择所需的仪器来判断;
(2)再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;
(3)分析操作对溶质物质的量、溶液体积的影响,根据c=$\frac{n}{V}$判断对溶液浓度的影响.
解答 解:(1)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.由提供的仪器可知不需要的仪器有:②烧瓶;④药匙;⑥托盘天平;还需要仪器有:100mL容量瓶、玻璃棒;
故答案为:②④⑥;100mL容量瓶、玻璃棒;
(2)根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,则有:
xmL×18.4mol/L=100mL×1mol/L,解得:x≈5.4,
故答案为:5.4;
(3)A.容量瓶中原来含有少量蒸馏水,对溶液的体积无影响,所配制溶液浓度不变,故A错误;
B.未经冷却,立即转移至容量瓶并洗涤烧杯,热的溶液体积偏大,冷却后溶液体积变小,导致配制的溶液体积偏小,所配制溶液浓度偏大,故B正确;
C.烧杯没有洗涤,导致配制的溶液中溶质的物质的量偏小,所配制溶液浓度偏小,故C错误;
D.向容量瓶中加水定容时眼睛一直仰视刻度线,液面超过刻度线,溶液的体积偏大,所配制溶液浓度偏小,故D错误;
故答案为:B.
点评 本题考查了溶液配制的方法,题目难度不大,明确配制方法为解答关键,注意掌握误差分析的方法与技巧,试题侧重基础知识的考查,培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
12.一定条件下,在一个密闭的容器中,铁与CO2发生反应:Fe(s)+CO2(g)$\stackrel{一定条件}{?}$FeO(s)+CO(g)△H>0,并且从正向建立平衡,下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$发生变化的是( )
| A. | 降低温度 | B. | 增大压强 | C. | 充入一定量CO2 | D. | 再加入一些铁粉 |
9.以下说法正确的是( )
| A. | 制备乙酸乙酯的实验中,承接酯的小试管中盛放了一定量的氢氧化钠溶液 | |
| B. | 实验室制乙烯时应将无水乙醇缓慢加入到浓硫酸中 | |
| C. | 在酸性重铬酸钾溶液中加入少量乙醇,橙色溶液变红 | |
| D. | 为减缓反应速率,将饱和食盐水滴加到烧瓶中的电石上来制取乙炔 |
16.使用酸碱中和滴定的方法,用0.01mol/L盐酸滴定锥形瓶中未知浓度的NaOH溶液,下列操作能够使测定结果偏高的是( )
| A. | 用量筒量取浓盐酸配制0.01mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸 | |
| B. | 配制稀盐酸定容时,俯视容量瓶刻度线 | |
| C. | 滴定前尖嘴处无气泡,滴定终点时有气泡 | |
| D. | 滴定过程中用少量蒸馏水将锥形瓶内避粘附的盐酸冲下 |
6.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 0.3mol氢气中含有氢原子的数目为0.3NA | |
| B. | 标准状况下,4.48L苯中含有苯分子的数目为0.2NA | |
| C. | 0.2mol•L-1CaCl2溶液中含有氯离子的数目为0.4NA | |
| D. | 1molNa2O2与足量水反应,转移的电子数为NA |
13.如图是某有机物分子的球棍模型.关于该物质的说法正确的是( )


| A. | 可以与醋酸发生中和反应 | B. | 能发生催化氧化反应 | ||
| C. | 能使紫色石蕊试液变红色 | D. | 能使溴的四氯化碳溶液褪色 |
10.已知NaHSO3溶液显酸性,溶液中存在以下平衡:HSO+-+H20?H2SO2+OH-①HSO3-?H++SO32-②.向0.1mol•L-1的NaHSO3溶液中分别加入以下物质,下列有挂说法正确的是( )
| A. | 加水稀释、平衡①、②均向右移,溶液中c(HSO3-)、c(H)+均减小 | |
| B. | 加入少量NaOH溶液,$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$、$\frac{c(O{H}^{-})}{c({H}^{+})}$的值均增大 | |
| C. | 加入少量Na2SO3固体,则c(H+)+c(Na+)=c(${HSO}_{3}^{-}$)+c(OH-)+$\frac{1}{2}$c(${SO}_{3}^{2-}$) | |
| D. | 加入氨水至中性,则2c(Na+)=c(${SO}_{3}^{2-}$)>c(H+)=c(OH-) |
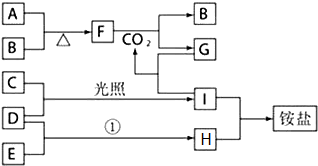 某兴趣小组的同学发现《高中化学(必修1)》中学习的单质及其化合物(或其溶液)存在如图的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;F为淡黄色粉末,化合物H和I通常状况下呈气体;反应①是化工生产中的一种重要固氮反应.
某兴趣小组的同学发现《高中化学(必修1)》中学习的单质及其化合物(或其溶液)存在如图的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;F为淡黄色粉末,化合物H和I通常状况下呈气体;反应①是化工生产中的一种重要固氮反应.