题目内容
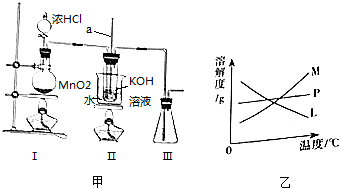
20.以下海带提碘的实验方案可以缩短实验时间,避免Cl2和CCl4的毒性.其实验流程如下:
回答下列问题:
(1)步骤①的操作名称是过滤;所需玻璃仪器有玻璃棒、烧杯和漏斗.
(2)步骤②中加入H2O2后发生反应的化学方程式为H2O2+2NaI+H2SO4→Na2SO4+2H2O+I2(或H2O2+2HI→2H2O+I2);选择用H2O2做氧化剂的原因是氯气有毒,双氧水比较安全.
(3)检验I2的水溶液中含有单质碘的方法是,取样于试管中,加入淀粉,如溶液显蓝色,则可证明含有碘单质.
(4)步骤③的操作名称是萃取;石油醚能用作萃取剂,说明石油醚具有的性质是石油醚不溶于水,碘在石油醚中的溶解度比在水中的大很多.
(5)步骤⑤通过敞口挥发就能得到固体碘,说明石油醚具有良好的挥发.
分析 海带灼烧后海带灰中含有碘化钾等物质,溶于水,浸泡过滤得到含有碘离子的溶液,加入硫酸和过氧化氢,发生氧化还原反应生成碘,既然后加入石油醚发生萃取,将萃取液敞口挥发,得到碘,
(1)步骤①为过滤操作,所需玻璃仪器有玻璃棒、烧杯和漏斗;
(2)H2O2为绿色氧化剂,发生氧化还原反应生成碘;
(3)淀粉遇碘变蓝色;
(4)步骤③为萃取操作;
(5)油醚具有良好的挥发性.
解答 解:海带灼烧后海带灰中含有碘化钾等物质,溶于水,浸泡过滤得到含有碘离子的溶液,加入硫酸和过氧化氢,发生氧化还原反应生成碘,既然后加入石油醚发生萃取,将萃取液敞口挥发,得到碘,
(1)步骤①为过滤操作,用于分离固体和液体,所需玻璃仪器有玻璃棒、烧杯和漏斗,故答案为:过滤;漏斗;
(2)步骤②中加入H2O2,为绿色氧化剂,对环境没有污染,可代替氯气,防止污染环境,发生氧化还原反应生成碘,发生反应的化学方程式为H2O2+2NaI+H2SO4→Na2SO4+2H2O+I2(或H2O2+2HI→2H2O+I2),
故答案为:H2O2+2NaI+H2SO4→Na2SO4+2H2O+I2(或H2O2+2HI→2H2O+I2);氯气有毒,双氧水比较安全;
(3)淀粉遇碘变蓝色,故答案为:蓝;
(4)步骤③为萃取操作,因石油醚不溶于水,碘在石油醚中的溶解度比在水中的大很多,
故答案为:萃取;石油醚不溶于水,碘在石油醚中的溶解度比在水中的大很多;
(5)步骤⑤通过敞口挥发就能得到固体碘,说明石油醚具有良好的挥发性,故答案为:挥发.
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析、实验能力的考查,涉及过滤操作、氧化还原反应等,为高考常见题型,利用所学知识结合流程图信息是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
10.已知NaHSO3溶液显酸性,溶液中存在以下平衡:HSO+-+H20?H2SO2+OH-①HSO3-?H++SO32-②.向0.1mol•L-1的NaHSO3溶液中分别加入以下物质,下列有挂说法正确的是( )
| A. | 加水稀释、平衡①、②均向右移,溶液中c(HSO3-)、c(H)+均减小 | |
| B. | 加入少量NaOH溶液,$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$、$\frac{c(O{H}^{-})}{c({H}^{+})}$的值均增大 | |
| C. | 加入少量Na2SO3固体,则c(H+)+c(Na+)=c(${HSO}_{3}^{-}$)+c(OH-)+$\frac{1}{2}$c(${SO}_{3}^{2-}$) | |
| D. | 加入氨水至中性,则2c(Na+)=c(${SO}_{3}^{2-}$)>c(H+)=c(OH-) |
8.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法不正确的是( )
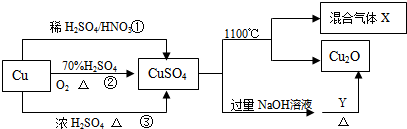

| A. | 将CuSO4溶液蒸发浓缩、冷却结晶可制得胆矾晶体 | |
| B. | 相对于途径①③,途径②更好地体现了绿色化学思想 | |
| C. | CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | Y可能是葡萄糖 |
15.下列物质属于共价化合物的是( )
| A. | 氯气 | B. | 氨气 | C. | 氯化钠 | D. | 氧化镁 |
5.用下列装置进行相应的实验,装置正确且能达到实验目的是( )
| A. |  用图所示装置验证 NaHCO 3 的不稳定性 | |
| B. | 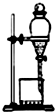 用图所示装置提取苯硝化反应后的产物 | |
| C. | 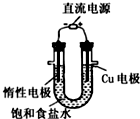 用图所示装置模拟氯碱工业生产氯气 | |
| D. | 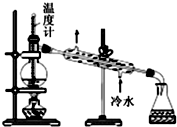 用图所示装置分馏石油 |
12.在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2mol/L和1.5mol/L,现向该溶液中加入39.2g铁粉使其充分反应.下列有关说法正确的是( )
| A. | 反应后溶液中Fe3+物质的量为0.8mol | |
| B. | 反应后产生13.44L H2(标准状况) | |
| C. | 反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol | |
| D. | 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 |
9.NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 25℃时,1LpH=13的Ba(OH)2溶液中含有的OH-数为0.2NA | |
| B. | 18gD2O中含有的质子数为9NA | |
| C. | Fe在少量Cl2中燃烧生成0.5mol产物,转移的电子数为NA | |
| D. | 标准状况下,11.2LCCl4含有的分子数为0.5NA |
10.高氯酸钾广泛用于火箭及热电池等领域.实验室制取高氯酸钾的步骤为:
称取一定质量的KCl、NaClO4,溶解后混合,经冷却、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到,有关物质溶解度与温度的关系如下表:
(1)写出实验室制取高氯酸钾的化学方程式NaClO4+KCl═KClO4↓+NaCl;用蒸馏水多次洗涤晶体的目的是尽可能除去溶解度较大的杂质.
(2)热电池是以熔盐作电解质,利用热源使其溶化而激活得一次储备电池.Li/FeS2热电池工作时,Li转变为硫化锂,FeS2转变为铁,该电池工作时,电池总反应为FeS2+4Li═Fe+2Li2S.
(3)Fe和KClO4反应放出的热量能为熔融盐电池提供550-660℃的温度,使低熔点盐熔化导电,从而激活电池,其供热原理为:KClO4 (s)+4Fe(s)═KCl (s)+4FeO(s),△H<0.
①600℃时FeO可部分分解生成Fe3O4,写出有关的化学方程式4FeO=Fe3O4+Fe.
②称取一定质量上述加热材料反应后的混合物(假定只含氯化钾一种钾盐)于烧杯中,用蒸馏水充分洗涤、过滤、干燥,固体质量减少了0.43g,在固体中继续加入过量的稀硫酸,微热让其充分反应,固体完全溶解得到的溶液中加入过量的NaOH溶液,经过滤、洗净、干燥,再在空气中充分灼烧得6.0 g棕色固体.求该加热材料反应前,铁和高氯酸钾的质量.(写出计算过程,结果保留2位有效数字)该加热材料反应前铁和高氯酸钾的质量分别为4.2g、0.80g.
称取一定质量的KCl、NaClO4,溶解后混合,经冷却、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到,有关物质溶解度与温度的关系如下表:
| 温度 溶解度 化学式 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| KClO4 | 0.76 | 1.06 | 1.68 | 2.56 | 3.73 |
| KCl | 28 | 31.2 | 34.2 | 37.2 | 40.1 |
| NaClO4 | 167 | 183 | 201 | 222 | 245 |
(2)热电池是以熔盐作电解质,利用热源使其溶化而激活得一次储备电池.Li/FeS2热电池工作时,Li转变为硫化锂,FeS2转变为铁,该电池工作时,电池总反应为FeS2+4Li═Fe+2Li2S.
(3)Fe和KClO4反应放出的热量能为熔融盐电池提供550-660℃的温度,使低熔点盐熔化导电,从而激活电池,其供热原理为:KClO4 (s)+4Fe(s)═KCl (s)+4FeO(s),△H<0.
①600℃时FeO可部分分解生成Fe3O4,写出有关的化学方程式4FeO=Fe3O4+Fe.
②称取一定质量上述加热材料反应后的混合物(假定只含氯化钾一种钾盐)于烧杯中,用蒸馏水充分洗涤、过滤、干燥,固体质量减少了0.43g,在固体中继续加入过量的稀硫酸,微热让其充分反应,固体完全溶解得到的溶液中加入过量的NaOH溶液,经过滤、洗净、干燥,再在空气中充分灼烧得6.0 g棕色固体.求该加热材料反应前,铁和高氯酸钾的质量.(写出计算过程,结果保留2位有效数字)该加热材料反应前铁和高氯酸钾的质量分别为4.2g、0.80g.