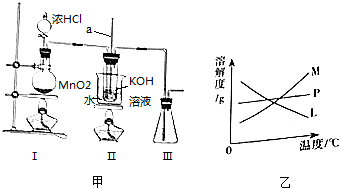
题目内容
3.下列微粒半径之比大于1的是( )| A. | Mg2+/Mg | B. | Cl/Cl- | C. | N/O | D. | Na+/F |
分析 同种元素的阳离子半径小于原子半径,同种元素的阴离子半径大于原子半径,同周期元素的原子半径从左向右在减小,以此来解答.
解答 解:A.因同种元素的阳离子半径小于原子半径,则Mg2+/Mg小于1,故A不选;
B.因同种元素的阴离子半径大于原子半径,则Cl/Cl-小于1,故B不选;
C.N、O都在同周期,同周期元素的原子半径从左向右在减小,则N/O大于1,故C选;
D.二者的电子层一样,但是钠离子的质子数大于F原子,所以钠离子半径小于F原子,则比值小于1,故D不选;
故选C.
点评 本题考查微粒半径的比较,明确原子半径的比较方法、离子半径与原子半径的关系即可解答,题目难度不大.

练习册系列答案
相关题目
13.如图是某有机物分子的球棍模型.关于该物质的说法正确的是( )


| A. | 可以与醋酸发生中和反应 | B. | 能发生催化氧化反应 | ||
| C. | 能使紫色石蕊试液变红色 | D. | 能使溴的四氯化碳溶液褪色 |
14.下列我国古代的技术应用中,其工作原理不涉及化学反应的是( )
| A. | 铁的冶炼 | B. | 火药使用 | C. | 粮食酿酒 | D. | 转轮排字 |
18.下列不属于金属单质共性的是( )
| A. | 导电性 | B. | 延展性 | C. | 高熔点 | D. | 金属光泽 |
8.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法不正确的是( )
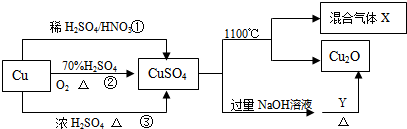

| A. | 将CuSO4溶液蒸发浓缩、冷却结晶可制得胆矾晶体 | |
| B. | 相对于途径①③,途径②更好地体现了绿色化学思想 | |
| C. | CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | Y可能是葡萄糖 |
15.下列物质属于共价化合物的是( )
| A. | 氯气 | B. | 氨气 | C. | 氯化钠 | D. | 氧化镁 |
12.在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2mol/L和1.5mol/L,现向该溶液中加入39.2g铁粉使其充分反应.下列有关说法正确的是( )
| A. | 反应后溶液中Fe3+物质的量为0.8mol | |
| B. | 反应后产生13.44L H2(标准状况) | |
| C. | 反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol | |
| D. | 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 |
13.某研究性学习小组对钠在CO2气体中燃烧进行了下列实验:
(1)该小组同学对管壁的白色物质的成分进行讨论并提出假设:
Ⅰ.白色物质可能是Na2O;
Ⅱ.白色物质可能是Na2CO3
Ⅲ.白色物质还可能是Na2O和Na2CO3混合物
(2)为确定该白色物质的成分,该小组进行了如下实验:
①通过对上述实验的分析,你认为上述三个假设中,Ⅱ成立.
②则钠在CO2中燃烧的化学方程式为4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2CO3+C.
③丙同学认为白色物质有可能是氢氧化钠,你认为是否合理并说出理由不正确,因为反应物中无H元素(或违背质量守恒定律).
(3)丁同学称取Na2O样品mg(假设只含有Na2O2杂质),请你与他合作从下面选用合适的仪器和试剂,设计一种可选用的实验仪器组合,填写下表以完成样品中Na2O含量的测定.可选用的试剂:
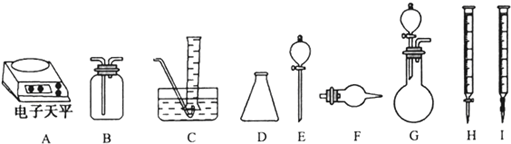
a.浓硫酸 b.水 c.盐酸标准溶液 d.NaOH 标准溶液 e.酚酞 f.碱石灰 g.稀盐酸
(4)某学生设计了以下实验方案来测定该试样中Na2O的质量分数,其操作流程和实验数据如下:
7.75gNa2O样品$\stackrel{在氧气中充分灼烧}{→}$固体$\stackrel{冷却}{→}$称量得固体9.35g.该Na2O产品中Na2O的质量分数为80%.
| 操作过程 | 实验现象 |
| 将干燥纯净的CO2缓缓通过放有钠的已排尽空气的干燥玻璃管中,加热 | 钠燃烧,火焰为黄色 |
| 反应后冷却 | 管壁附有黑色颗粒和白色物质 |
Ⅰ.白色物质可能是Na2O;
Ⅱ.白色物质可能是Na2CO3
Ⅲ.白色物质还可能是Na2O和Na2CO3混合物
(2)为确定该白色物质的成分,该小组进行了如下实验:
| 实验步骤 | 实验现象 |
| ①少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加过量的CaC12溶液出现白色沉淀 | 出现白色沉淀 |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
②则钠在CO2中燃烧的化学方程式为4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2CO3+C.
③丙同学认为白色物质有可能是氢氧化钠,你认为是否合理并说出理由不正确,因为反应物中无H元素(或违背质量守恒定律).
(3)丁同学称取Na2O样品mg(假设只含有Na2O2杂质),请你与他合作从下面选用合适的仪器和试剂,设计一种可选用的实验仪器组合,填写下表以完成样品中Na2O含量的测定.可选用的试剂:

a.浓硫酸 b.水 c.盐酸标准溶液 d.NaOH 标准溶液 e.酚酞 f.碱石灰 g.稀盐酸
| 实验过程中发生反应的化学方程式 | 实验所需仪器(用字母表示) | 实验所需试剂(用字表示) | 实验需直接测定的有关物理量(用文字说明) |
7.75gNa2O样品$\stackrel{在氧气中充分灼烧}{→}$固体$\stackrel{冷却}{→}$称量得固体9.35g.该Na2O产品中Na2O的质量分数为80%.