题目内容
10.图中各物质,已知D为正盐,B、N为无色气体单质,E、Q为刺激性气味气体,L为黑色固体,M是红色固体.J、K均是同种金属的氯化物,且K为白色沉淀(部分反应的产物未列出).请回答下列问题: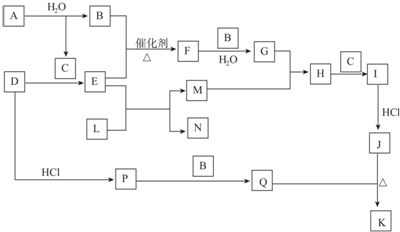
(1)A的电子式
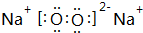 ,D的化学式(NH4)2S.
,D的化学式(NH4)2S.(2)A和P按1:3比例在水溶液中反应的离子方程式3H2S+Na2O2═2Na++S↓+2HS-+2H2O.
(3)B和E反应的方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(4)写出Q和J生成K的离子方程式2Cu2++2Cl-+SO2+2H2O═2CuCl↓+4H++SO42-.
分析 根据“J、K均是同种金属的氯化物,且K为白色沉淀”则不是铁盐,应是铜盐,即J是CuCl2、K是CuCl,Q是具有刺激性气味、具有还原性的气体,I是CuO或Cu(OH)2,则M是铜,L是氧化铜,E是氨气,N为氮气,B是氧气,F是NO,G是硝酸,H是Cu(NO3)2,联系A与水反应生成B(氧气),则C是NaOH,A为Na2O2,I是Cu(OH)2,D是铵盐,D其中阴离子具有还原性,是弱酸、还原性离子,联系Q知D是(NH4)2S,P是H2S,Q是SO2.
解答 解:根据“J、K均是同种金属的氯化物,且K为白色沉淀”则不是铁盐,应是铜盐,即J是CuCl2、K是CuCl,Q是具有刺激性气味、具有还原性的气体,I是CuO或Cu(OH)2,则M是铜,L是氧化铜,E是氨气,N为氮气,B是氧气,F是NO,G是硝酸,H是Cu(NO3)2,联系A与水反应生成B(氧气),则C是NaOH,A为Na2O2,I是Cu(OH)2,D是铵盐,D其中阴离子具有还原性,是弱酸、还原性离子,联系Q知D是(NH4)2S,P是H2S,Q是SO2.
(1)A是Na2O2,电子式为 ,D的化学式是(NH4)2S,
,D的化学式是(NH4)2S,
故答案为: ;(NH4)2S;
;(NH4)2S;
(2)A和P按1:3比例在水溶液中反应的离子方程式:3H2S+Na2O2═2Na++S↓+2HS-+2H2O,
故答案为:3H2S+Na2O2═2Na++S↓+2HS-+2H2O;
(3)B和E反应的方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(4)Q和J生成K的离子方程式:2Cu2++2Cl-+SO2+2H2O═2CuCl↓+4H++SO42-,
故答案为:2Cu2++2Cl-+SO2+2H2O═2CuCl↓+4H++SO42-.
点评 本题考查无机物推断,题目涉及物质较多,物质的颜色为推断突破口,但不是非常明显,尤其是中学不涉及CuCl,需要学生熟练掌握元素化合物性质,难度较大.

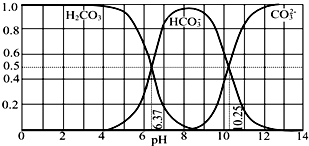
| A. | pH=10.25时,c(Na+)═c(CO32-)+c(HCO3-) | |
| B. | 为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间 | |
| C. | 根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37 | |
| D. | 若是0.1mol NaOH 反应后所得的1L溶液,pH=10时,溶液中存在以下关系:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| A. | 根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不与浓硫酸发生反应 | |
| B. | 过氧化钠可作为防毒面具和潜水艇内的供氧剂 | |
| C. | 可用稀硝酸鉴别铜锌合金制成的假金币 | |
| D. | 氢氟酸可用于雕刻玻璃 |
| A. | A=B | B. | A<B | C. | 无法判断 | D. | A>B |
| A. | 离子半径:D>B>C>A | |
| B. | 金属性:B>C | |
| C. | A、D最高化合价与最低化合价的代数和分别为0和6 | |
| D. | B和A、C形成的氧化物均不反应 |

| A. | 白色沉淀A可能能溶解在溶液D | |
| B. | 在甲中滴加丁可能发生反应:HCO3+Ba2++OH-=BaCO3↓+H2O | |
| C. | 溶液丙与I-、N03-、SO42-可以大量共存 | |
| D. | 溶液甲中一定满足:c(H2CO3)+c(H+)═c(OH-)+c(CO32-) |
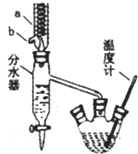 苯甲酸具有弱酸性,可以和乙醇发生酯化反应生成苯甲酸乙酯.苯甲酸乙脂 (密度1.05g ?cm-3)稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等.制备苯甲酸乙脂的过程如下:
苯甲酸具有弱酸性,可以和乙醇发生酯化反应生成苯甲酸乙酯.苯甲酸乙脂 (密度1.05g ?cm-3)稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等.制备苯甲酸乙脂的过程如下:(1)制备粗产品:如图所示装置中,于50mL圆底烧瓶中加人8.0g苯甲酸(Mr=122)、20mL乙醇(Mr=46,密度0.79g?cm-3)、15mL环己烷、3mL浓硫酸,摇匀,加沸石.在分水器上加水,接通冷凝水,水浴回流约2h,反应基本完成.记录体积,继续蒸出多余环己烷和醇(从分水器中放出).
(2)粗产品纯化:加水30ml.,分批加人固体NaHCO3,分液,然后水层用20mL石油醚分两次萃取.合并有机层,用无水硫酸镁干燥.回收石油醚,加热精馏,收集210一213℃馏分.
相关数据如表:
| 沸点(℃,1atm) | ||||||
| 苯甲酸 | 苯甲酸乙酯 | 石油醚 | 水 | 乙醇 | 环己烷 | 共沸物(环已烷-水-乙醇) |
| 249 | 212.6 | 40-80 | 100 | 78.3 | 80.75 | 62.6 |
(1)写出制备苯甲酸乙醋反应的化学方程式
 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$ +H2O仪器a的名称冷凝管,b口的作用为出水口,
+H2O仪器a的名称冷凝管,b口的作用为出水口,(2)请说出在本实验中可以采取的能提高笨甲酸乙酸产率的方法加入环已烷形成水-乙醇-环已烷三元共沸物分离出反应过程中生成的水,或加过量的乙醇,或使用分液器及时分离子出生成的水等(写出任意一种即可).
(3)如何利用实验现象判断反应已基本完成加热回流至分水器中水位不再上升
(4)固体NaHCO.的作用中和硫酸和未反应的苯甲酸,加人固体NaHCO3时的实验操作所用到的主要玻璃仪器为分液漏斗.
(5)经精馏得210-213℃馏分7.0mL,则实验中苯甲酸乙脂的产率为73.7%.
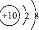 .
.