题目内容
14. 苯甲酸具有弱酸性,可以和乙醇发生酯化反应生成苯甲酸乙酯.苯甲酸乙脂 (密度1.05g ?cm-3)稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等.制备苯甲酸乙脂的过程如下:
苯甲酸具有弱酸性,可以和乙醇发生酯化反应生成苯甲酸乙酯.苯甲酸乙脂 (密度1.05g ?cm-3)稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等.制备苯甲酸乙脂的过程如下:(1)制备粗产品:如图所示装置中,于50mL圆底烧瓶中加人8.0g苯甲酸(Mr=122)、20mL乙醇(Mr=46,密度0.79g?cm-3)、15mL环己烷、3mL浓硫酸,摇匀,加沸石.在分水器上加水,接通冷凝水,水浴回流约2h,反应基本完成.记录体积,继续蒸出多余环己烷和醇(从分水器中放出).
(2)粗产品纯化:加水30ml.,分批加人固体NaHCO3,分液,然后水层用20mL石油醚分两次萃取.合并有机层,用无水硫酸镁干燥.回收石油醚,加热精馏,收集210一213℃馏分.
相关数据如表:
| 沸点(℃,1atm) | ||||||
| 苯甲酸 | 苯甲酸乙酯 | 石油醚 | 水 | 乙醇 | 环己烷 | 共沸物(环已烷-水-乙醇) |
| 249 | 212.6 | 40-80 | 100 | 78.3 | 80.75 | 62.6 |
(1)写出制备苯甲酸乙醋反应的化学方程式
 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$ +H2O仪器a的名称冷凝管,b口的作用为出水口,
+H2O仪器a的名称冷凝管,b口的作用为出水口,(2)请说出在本实验中可以采取的能提高笨甲酸乙酸产率的方法加入环已烷形成水-乙醇-环已烷三元共沸物分离出反应过程中生成的水,或加过量的乙醇,或使用分液器及时分离子出生成的水等(写出任意一种即可).
(3)如何利用实验现象判断反应已基本完成加热回流至分水器中水位不再上升
(4)固体NaHCO.的作用中和硫酸和未反应的苯甲酸,加人固体NaHCO3时的实验操作所用到的主要玻璃仪器为分液漏斗.
(5)经精馏得210-213℃馏分7.0mL,则实验中苯甲酸乙脂的产率为73.7%.
分析 (1)根据题干信息知,苯甲酸和乙醇反应生成苯甲酸乙酯和水,根据装置图可知仪器a的名称为冷凝管,根据逆流的冷却效果好可判断出b口的作用为出水口;
(2)苯甲酸和乙醇反应生成苯甲酸乙酯和水的反应为可逆反应,根据影响平衡移动的因素可确定提高苯甲酸乙酸产率的方法;
(3)根据分水器中水位判断反应是否基本完成;
(4)碳酸氢钠能和酸反应;加人固体NaHCO3后分液,所以要用分液漏斗;
(5)根据苯甲酸的质量计算理论上生成苯甲酸乙酯的质量,该反应的产率等于实际值与理论值的比.
解答 解:(1)根据题干信息知,苯甲酸和乙醇反应生成苯甲酸乙酯和水,化学反应方程式为: +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$ +H2O,根据装置图可知仪器a的名称为冷凝管,根据逆流的冷却效果好可判断出b口的作用为出水口,
+H2O,根据装置图可知仪器a的名称为冷凝管,根据逆流的冷却效果好可判断出b口的作用为出水口,
故答案为: +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$ +H2O;冷凝管;出水口;
+H2O;冷凝管;出水口;
(2)苯甲酸和乙醇反应生成苯甲酸乙酯和水的反应为可逆反应,所以要提高苯甲酸乙酸产率的方法有加入环已烷形成水-乙醇-环已烷三元共沸物分离出反应过程中生成的水、加过量的乙醇、使用分液器及时分离子出生成的水等,
故答案为:加入环已烷形成水-乙醇-环已烷三元共沸物分离出反应过程中生成的水,或加过量的乙醇,或使用分液器及时分离子出生成的水等;
(3)甲酸和乙醇反应生成苯甲酸乙酯和水,分水器中可收集到水,所以判断反应已基本完成的方法是加热回流至分水器中水位不再上升,
故答案为:加热回流至分水器中水位不再上升;
(4)碳酸氢钠具有碱性,能和硫酸和苯甲酸反应生成盐,所以加入碳酸氢钠的目的是中和硫酸和未反应的苯甲酸,加人固体NaHCO3后分液,所以要用分液漏斗,
故答案为:中和硫酸和未反应的苯甲酸;分液漏斗;
(5)8.0g苯甲酸(固体)和乙醇反应生成苯甲酸乙酯的质量=$\frac{8.0g}{122g/mol}$×152g/mol=9.97g,实际上苯甲酸乙酯的质量=1.05g•mL-3×7mL=7.35g,则该反应的产率为=$\frac{7.35g}{9.97g}$=73.7%,
故答案为:73.7%.
点评 本题考查了物质制备,明确实验原理是解本题关键,根据实验原理及物质的性质来分析解答,很多学生对有机化学实验知识了解较少,解答时易出现错误,要熟练掌握教材基础知识,灵活运用基础知识来分析解答,题目难度中等.

| A. | NaOH | B. | NH3 | C. | CaCl2 | D. | H2S04 |
| A. | 在氧气中点燃细铁丝产生白色的烟 | |
| B. | 铁粉和硫粉混合加热生成黑色固体 | |
| C. | 纯铝在空气中放置会长出白毛 | |
| D. | 将铝片放入CuSO4溶液反应完全后,溶液由蓝色变为红色 |
| A. | 除去乙烷中少量的乙烯:催化剂条件下通入H2 | |
| B. | 乙醇中含有乙酸杂质:加入 碳酸钠溶液,分液 | |
| C. | FeCl3溶液中含有CuCl2杂质:加入过量铁粉,过滤 | |
| D. | CO2中含有HCl杂质:通入饱和NaHCO3溶液,洗气 |
| A. | 计算机芯片 | B. | 光导纤维 | C. | 陶瓷餐具 | D. | 石英钟表 |
| A. | 元素 | B. | 单质 | C. | 原子 | D. | 氧化物 |
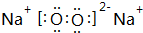 ,D的化学式(NH4)2S.
,D的化学式(NH4)2S.

 .
.