题目内容
H2A是一种弱酸,已知常温下0.1mol/L NaHA溶液呈酸性.关于该溶液中微粒浓度的以下判断中,可能错误的是( )
| A、c(A2-)+c(OH-)=c(H2A)+c(H+) |
| B、c(HA-)>c(A2-)>c(H2A) |
| C、c(HA-)>c(H+)>c(OH-) |
| D、c(HA-)>c(OH-)>c(A2-) |
考点:离子浓度大小的比较,盐类水解的应用
专题:盐类的水解专题
分析:H2A是一种弱酸,常温下0.1mol/L NaHA溶液呈酸性,说明HA-的电离程度大于水解程度,再结合电荷守恒和物料守恒解答.
解答:
解:H2A是一种弱酸,常温下0.1mol/L NaHA溶液呈酸性,说明HA-的电离程度大于水解程度,
A.根据电荷守恒得c(HA-)+2c(A2-)+c(OH-)=c(Na+)+c(H+),根据物料守恒得c(Na+)=c(HA-)+c(A2-)+c(H2A),所以得c(A2-)+c(OH-)=c(H2A)+c(H+),故A正确;
B.常温下0.1mol/L NaHA溶液呈酸性,则HA-的电离程度大于水解程度,HA-的电离和水解程度都较小,所以存在c(HA-)>c(A2-)>c(H2A),故B正确;
C.溶液呈酸性,则c(H+)>c(OH-),HA-的电离和水解程度都较小,所以存在c(HA-)>c(H+)>c(OH-),故C正确;
D.HA-的电离程度大于水解程度,HA-的电离和水解程度都较小,所以存在c(HA-)>c(A2-)>c(OH-),故D错误;
故选D.
A.根据电荷守恒得c(HA-)+2c(A2-)+c(OH-)=c(Na+)+c(H+),根据物料守恒得c(Na+)=c(HA-)+c(A2-)+c(H2A),所以得c(A2-)+c(OH-)=c(H2A)+c(H+),故A正确;
B.常温下0.1mol/L NaHA溶液呈酸性,则HA-的电离程度大于水解程度,HA-的电离和水解程度都较小,所以存在c(HA-)>c(A2-)>c(H2A),故B正确;
C.溶液呈酸性,则c(H+)>c(OH-),HA-的电离和水解程度都较小,所以存在c(HA-)>c(H+)>c(OH-),故C正确;
D.HA-的电离程度大于水解程度,HA-的电离和水解程度都较小,所以存在c(HA-)>c(A2-)>c(OH-),故D错误;
故选D.
点评:本题考查了离子浓度大小比较,根据溶液酸碱性确定酸式酸根离子水解程度和电离程度相对大小,再结合物料守恒、电荷守恒来分析解答,题目难度中等.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
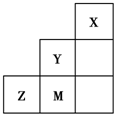
如图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是( )
 ??
??
 ??
??| A、非金属性:Y>Z>M |
| B、离子半径:M->Z2->Y- |
| C、Z元素最高价氧化物的对应水化物的浓溶液具有强氧化性和不挥发性 |
| D、三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
下列关于稀有气体的叙述正确的是( )
| A、原子的最外电子层都有8个电子 |
| B、化学性质非常不活泼 |
| C、其原子与同周期ⅠA、ⅡA族阳离子具有相同的核外电子排布 |
| D、原子半径比同周期ⅦA族元素原子的小 |
 短周期金属元素甲~戊在元素周期表中的相对位置如图所示,下面判断正确的是( )
短周期金属元素甲~戊在元素周期表中的相对位置如图所示,下面判断正确的是( )| A、原子半径:丙<丁<戊 |
| B、元素金属性:甲>丙 |
| C、氢氧化物碱性:丙<丁<戊 |
| D、丙的最高价氧化物水化物与戊的最高价氧化物水化物能发生反应 |
 图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法正确的是( )
图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法正确的是( )| A、电池的能量转化率可达100% |
| B、铝罐是电池的负极 |
| C、碳棒应与玩具电机的负极相连 |
| D、电池工作一段时间后碳棒和炭粒的质量会减轻 |
下列电池中不属于二次电池的是( )
| A、碱性锌锰电池 | B、铅蓄电池 |
| C、镍镉电池 | D、锂离子电池 |
 四种短周期元素在周期表中的相对位置如图所示,下列说法错误的是( )
四种短周期元素在周期表中的相对位置如图所示,下列说法错误的是( )| A、X和Y元素的原子最外层电子数之和等于Z元素的原子最外层电子数的2倍 |
| B、Y元素的非金属性强于W元素的,其最高价氧化物水化物的酸性也强于W的 |
| C、X最简单氢化物溶于水呈碱性,Z最简单氢化物溶于水呈酸性 |
| D、W元素形成的单质可以从Z元素氢化物的水溶液中置换出Z单质 |
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下: