题目内容
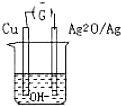 普通水泥在固化过程中自由水分子减少并产生胶体溶液呈碱性.根据这一物理化学特点科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+Ag 下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少并产生胶体溶液呈碱性.根据这一物理化学特点科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+Ag 下列有关说法正确的是( )| A、工业上以黏土、石灰石为主要原料来制造水泥 |
| B、测量原理示意图中 Ag2O为负极 |
| C、负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O |
| D、电池工作时OH-向正极移动 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由电池反应方程式2Cu+Ag2O=Cu2O+2Ag知,较活泼的金属铜失电子发生氧化反应,所以铜作负极,较不活泼的金属银作正极,原电池放电时,溶液中阳离子向正极移动,阴离子向负极移动;根据转移电子和氧化亚铜的关系计算转移电子数.
解答:
解:A.制造水泥的主要原料为粘土、石灰石等,故A正确;
B.由电池反应方程式2Cu+Ag2O=Cu2O+2Ag知,较活泼的金属铜失电子发生氧化反应,所以铜作负极,Ag2O为正极,故B错误;
C.负极发生氧化反应,电极方程式为2Cu+2OH--2e-=Cu2O+H2O,故C正确;
D.原电池工作时,阴离子向负极移动,阳离子向正极移动,故D错误.
故选AC.
B.由电池反应方程式2Cu+Ag2O=Cu2O+2Ag知,较活泼的金属铜失电子发生氧化反应,所以铜作负极,Ag2O为正极,故B错误;
C.负极发生氧化反应,电极方程式为2Cu+2OH--2e-=Cu2O+H2O,故C正确;
D.原电池工作时,阴离子向负极移动,阳离子向正极移动,故D错误.
故选AC.
点评:本题以水泥的硬化为载体考查了原电池原理,难度不大,会根据电池反应式进行正负极及溶液中离子移动方向的判断是解本题的关键.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
Fe(OH)3胶体具有的性质是( )
| A、无色溶液 |
| B、分散质粒子直径大于100nm(10-7) |
| C、红褐色沉淀 |
| D、丁达尔效应 |
下列反应的离子方程式书写正确的是( )
| A、向KI溶液中通入少量氯气:Cl2+2I-=2Cl-+I2 |
| B、向AlCl3溶液中滴入少量氨水:Al3++3OH-=Al(OH)3↓ |
| C、向NaHCO3溶液中滴入少量稀硫酸:2H++CO32-=CO2↑+H2O |
| D、向Fe2(SO4)3溶液中加入少量铁粉:Fe3++Fe=2Fe2+ |
下列物质中,属于电解质的是( )
| A、铜 | B、酒精 | C、蔗糖 | D、氢氧化钠 |
X、Y、Z是周期表中相邻的三种短周期元素,它们原子半径依次减小,X与Z的核电荷数之比为3:4,X、Y、Z分别与氢元素形成氢化物.下列叙述正确的是( )
| A、Z是第二周期ⅣA族元素 |
| B、最高价氧化物对应的水化物的酸性:Y<X |
| C、非金属性:X<Y<Z |
| D、X、Y、Z的氢化物稳定性逐渐减弱 |
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A、1 L 1mol?L-1CaCl2溶液中含有的氯离子数为2NA |
| B、锌从盐酸中置换出1 mol H2,电子转移数为NA |
| C、常温常压下,11.2 L氧气含有的原子数为NA |
| D、4.4 g二氧化碳含有的原子数为0.1NA |
下列各组离子能大量共存的是( )
| A、NH4+、Na+、NO3-、OH- |
| B、Ca2+、Na+、Cl-、CO32- |
| C、K+、H+、SO42-、OH- |
| D、Na+、K+、OH-、Cl- |
 ,该离子的符号为
,该离子的符号为 所示,写出它的化学式
所示,写出它的化学式