题目内容
下列反应的离子方程式书写正确的是( )
| A、向KI溶液中通入少量氯气:Cl2+2I-=2Cl-+I2 |
| B、向AlCl3溶液中滴入少量氨水:Al3++3OH-=Al(OH)3↓ |
| C、向NaHCO3溶液中滴入少量稀硫酸:2H++CO32-=CO2↑+H2O |
| D、向Fe2(SO4)3溶液中加入少量铁粉:Fe3++Fe=2Fe2+ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.氯气氧化性大于碘单质,氯气能够将碘离子氧化成碘单质;
B.一水合氨为弱电解质,离子方程式中应该保留分子式;
C.碳酸氢钠与稀硫酸的离子方程式中,碳酸氢根离子不能拆开;
D.根据电荷守恒判断,该离子方程式两边总电荷不守恒.
B.一水合氨为弱电解质,离子方程式中应该保留分子式;
C.碳酸氢钠与稀硫酸的离子方程式中,碳酸氢根离子不能拆开;
D.根据电荷守恒判断,该离子方程式两边总电荷不守恒.
解答:
解:A.向KI溶液中通入少量氯气,反应生成碘单质和氯离子,反应的离子方程式为:Cl2+2I-=2Cl-+I2,故A正确;
B.向AlCl3溶液中滴入少量氨水,一水合氨应该保留分子式,正确的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故B错误;
C.向NaHCO3溶液中滴入少量稀硫酸,碳酸氢根离子不能拆开,正确的离子方程式为:H++HCO3-=CO2↑+H2O,故C错误;
D.向Fe2(SO4)3溶液中加入少量铁粉,铁与铁离子反应生成亚铁离子,离子方程式两边电荷不守恒,正确的离子方程式为:2Fe3++Fe=3Fe2+,故D错误;
故选A.
B.向AlCl3溶液中滴入少量氨水,一水合氨应该保留分子式,正确的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故B错误;
C.向NaHCO3溶液中滴入少量稀硫酸,碳酸氢根离子不能拆开,正确的离子方程式为:H++HCO3-=CO2↑+H2O,故C错误;
D.向Fe2(SO4)3溶液中加入少量铁粉,铁与铁离子反应生成亚铁离子,离子方程式两边电荷不守恒,正确的离子方程式为:2Fe3++Fe=3Fe2+,故D错误;
故选A.
点评:本题考查了离子方程式的正误判断,题目难度中等,试题侧重对学生能力的培养和训练,注意掌握离子方程式的书写原则,明确判断离子方程式常用方法,如(1)检查反应能否发生;(2)检查反应物、生成物是否正确;(3)检查各物质拆分是否正确;(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列反应属于吸热反应的是( )
A、CO2+C
| ||||
B、2Na+O2
| ||||
| C、Mg+2HCl═MgCl2+H2↑ | ||||
D、2Al+Fe2O3
|
下列实验基本操作(注意事项)中,主要出于安全考虑的是( )
| A、实验剩余的药品不能放回原试剂瓶 |
| B、可燃性气体点燃前进行验纯 |
| C、实验结束后将试管清洗干净 |
| D、胶头滴管不能交叉使用 |
下列各图所示的分子结构模型中,分子式为 C2H6O 的是( )
A、 |
B、 |
C、 |
D、 |
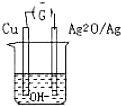 普通水泥在固化过程中自由水分子减少并产生胶体溶液呈碱性.根据这一物理化学特点科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+Ag 下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少并产生胶体溶液呈碱性.根据这一物理化学特点科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+Ag 下列有关说法正确的是( )| A、工业上以黏土、石灰石为主要原料来制造水泥 |
| B、测量原理示意图中 Ag2O为负极 |
| C、负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O |
| D、电池工作时OH-向正极移动 |
下列过程要吸收热量的是( )
| A、甲烷在空气中燃烧 |
| B、碳酸钙受热分解 |
| C、镁条溶于盐酸 |
| D、浓硫酸溶于水 |
 Ⅰ.(1)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液中c(Na+)
Ⅰ.(1)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液中c(Na+)