题目内容
下列各组离子能大量共存的是( )
| A、NH4+、Na+、NO3-、OH- |
| B、Ca2+、Na+、Cl-、CO32- |
| C、K+、H+、SO42-、OH- |
| D、Na+、K+、OH-、Cl- |
考点:离子共存问题
专题:离子反应专题
分析:如离子之间不发生复分解反应生成沉淀、气体或弱电解质,或不发生氧化还原反应、互促水解等反应,则可大量共存,结合题中离子的性质解答.
解答:
解:A.NH4+与OH-反应而不能大量共存,故A错误;
B.Ca2+与CO32-反应生成沉淀而不能大量共存,故B错误;
C.H+与OH-反应生成水而不能大量共存,故C错误;
D.离子之间不发生任何反应,可大量共存,故D正确.
故选D.
B.Ca2+与CO32-反应生成沉淀而不能大量共存,故B错误;
C.H+与OH-反应生成水而不能大量共存,故C错误;
D.离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评:本题考查离子共存问题,为高频考点,侧重于学生的分析能力和元素化合物知识的综合运用的考查,注意把握常见离子的性质以及反应类型的判断,难度不大,注意相关基础知识的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
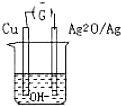 普通水泥在固化过程中自由水分子减少并产生胶体溶液呈碱性.根据这一物理化学特点科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+Ag 下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少并产生胶体溶液呈碱性.根据这一物理化学特点科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+Ag 下列有关说法正确的是( )| A、工业上以黏土、石灰石为主要原料来制造水泥 |
| B、测量原理示意图中 Ag2O为负极 |
| C、负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O |
| D、电池工作时OH-向正极移动 |
下列过程要吸收热量的是( )
| A、甲烷在空气中燃烧 |
| B、碳酸钙受热分解 |
| C、镁条溶于盐酸 |
| D、浓硫酸溶于水 |
下列离子方程式正确的是( )
| A、铝和稀盐酸反应:Al+2H+=Al3++H2↑ | ||
B、稀硝酸和碳酸钙反应:2H++CO
| ||
C、氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO
| ||
| D、用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-=Cl-+ClO-+H2O |
NA代表阿伏加德罗常数.下列叙述正确的是( )
| A、常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA |
| B、由CO和O2组成的混台物中共有NA个分子,其中的氧原子数为2NA |
| C、在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,转移电子数为2NA个 |
| D、0.1mol Fe粉与足量水蒸气反应生成的H2分子数为0.1NA |

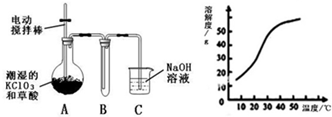 Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.