题目内容
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A、1 L 1mol?L-1CaCl2溶液中含有的氯离子数为2NA |
| B、锌从盐酸中置换出1 mol H2,电子转移数为NA |
| C、常温常压下,11.2 L氧气含有的原子数为NA |
| D、4.4 g二氧化碳含有的原子数为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.根据n=cV计算出氯化钙的物质的量,再计算出溶液中氯离子数目;
B.生成1mol氢气需要转移2mol电子;
C.常温常压下,不能使用标况下的气体摩尔体积计算氧气的物质的量;
D.二氧化碳的摩尔质量为44g/mol,4.4g二氧化碳的物质的量为0.1mol,含有0.3mol原子.
B.生成1mol氢气需要转移2mol电子;
C.常温常压下,不能使用标况下的气体摩尔体积计算氧气的物质的量;
D.二氧化碳的摩尔质量为44g/mol,4.4g二氧化碳的物质的量为0.1mol,含有0.3mol原子.
解答:
解:A.1 L 1mol?L-1CaCl2溶液中含有溶质氯化钙1mol,1mol氯化钙中含有2mol氯离子,含有的氯离子数为2NA,故A正确;
B.锌从盐酸中置换出1mol H2,氢气得到了2mol电子,电子转移数为2NA,故B错误;
C.不是标准状况下,不能使用标况下的气体摩尔体积计算11.2L氧气的物质的量,故C错误;
D.4.4g二氧化碳的物质的量为0.1mol,0.1mol二氧化碳中含有0.1mol碳原子、0.2mol氧原子,总共含有0.3mol原子,含有的原子数为0.3NA,故D错误;
故选A.
B.锌从盐酸中置换出1mol H2,氢气得到了2mol电子,电子转移数为2NA,故B错误;
C.不是标准状况下,不能使用标况下的气体摩尔体积计算11.2L氧气的物质的量,故C错误;
D.4.4g二氧化碳的物质的量为0.1mol,0.1mol二氧化碳中含有0.1mol碳原子、0.2mol氧原子,总共含有0.3mol原子,含有的原子数为0.3NA,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标准状况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
相关题目
下列实验基本操作(注意事项)中,主要出于安全考虑的是( )
| A、实验剩余的药品不能放回原试剂瓶 |
| B、可燃性气体点燃前进行验纯 |
| C、实验结束后将试管清洗干净 |
| D、胶头滴管不能交叉使用 |
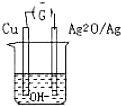 普通水泥在固化过程中自由水分子减少并产生胶体溶液呈碱性.根据这一物理化学特点科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+Ag 下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少并产生胶体溶液呈碱性.根据这一物理化学特点科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+Ag 下列有关说法正确的是( )| A、工业上以黏土、石灰石为主要原料来制造水泥 |
| B、测量原理示意图中 Ag2O为负极 |
| C、负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O |
| D、电池工作时OH-向正极移动 |
某溶液中存在大量的Na+、OH-、SO
,该溶液中还可能大量存在的离子是( )
2- 4 |
| A、Ba2+ | ||
B、AlO
| ||
| C、Mg2+ | ||
D、HCO
|
下列过程要吸收热量的是( )
| A、甲烷在空气中燃烧 |
| B、碳酸钙受热分解 |
| C、镁条溶于盐酸 |
| D、浓硫酸溶于水 |
下列离子方程式正确的是( )
| A、铝和稀盐酸反应:Al+2H+=Al3++H2↑ | ||
B、稀硝酸和碳酸钙反应:2H++CO
| ||
C、氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO
| ||
| D、用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-=Cl-+ClO-+H2O |
