题目内容
A、B、C、D四种可溶性盐,分别由Na+、Ba2+、Cu2+、Ag+、CO32-、SO42-、Cl-、NO3-中的不同阳离子和阴离子各一种组成.现做以下实验:
①将四种盐各取少量,分别溶于盛有5mL蒸馏水的四支试管中,只有B盐溶液呈蓝色.
②分别向4支试管中加入2mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象.
根据上述事实,推断这四种盐的化学式分别为:
A B C D .
①将四种盐各取少量,分别溶于盛有5mL蒸馏水的四支试管中,只有B盐溶液呈蓝色.
②分别向4支试管中加入2mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象.
根据上述事实,推断这四种盐的化学式分别为:
A
考点:常见离子的检验方法,几组未知物的检验
专题:物质检验鉴别题
分析:①Cu2+为蓝色,不能与CO32-共存,故B为铜盐且不为碳酸铜;
②A盐溶液中产生白色沉淀为氯化银,Ag+与CO32-、SO42-、Cl-不能共存,所以A盐为AgNO3;C盐溶液产生的气体为二氧化碳,说明C盐中含有CO32-,而CO32-与Ba2+、Cu2+、Ag+均可发生反应,故C盐为Na2CO3,因此D盐中含有Ba2+,由于Ba2+与SO42-不能共存,故D盐为BaCl2,则B盐为CuSO4.
②A盐溶液中产生白色沉淀为氯化银,Ag+与CO32-、SO42-、Cl-不能共存,所以A盐为AgNO3;C盐溶液产生的气体为二氧化碳,说明C盐中含有CO32-,而CO32-与Ba2+、Cu2+、Ag+均可发生反应,故C盐为Na2CO3,因此D盐中含有Ba2+,由于Ba2+与SO42-不能共存,故D盐为BaCl2,则B盐为CuSO4.
解答:
解:8种离子中只有Cu2+为蓝色,故B盐中含有Cu2+且不为碳酸铜;分别向4支试管中加入2mL稀盐酸之后,A盐溶液中产生白色沉淀为AgCl,说明A含有Ag+,由于Ag+与CO32-、SO42-、Cl-均可发生反应而不能共存,所以A盐为AgNO3;
C盐溶液中产生的气泡为CO2,说明C盐中含有CO32-,而CO32-与Ba2+、Cu2+、Ag+均可发生反应,故C盐为Na2CO3,因此D盐中含有的阳离子为Ba2+,
由于Ba2+与SO42-不能共存,故D盐为BaCl2,此时阴离子只剩下SO42-则B盐为CuSO4,
故答案为:AgNO3;CuSO4;Na2CO3;BaCl2.
C盐溶液中产生的气泡为CO2,说明C盐中含有CO32-,而CO32-与Ba2+、Cu2+、Ag+均可发生反应,故C盐为Na2CO3,因此D盐中含有的阳离子为Ba2+,
由于Ba2+与SO42-不能共存,故D盐为BaCl2,此时阴离子只剩下SO42-则B盐为CuSO4,
故答案为:AgNO3;CuSO4;Na2CO3;BaCl2.
点评:此题考查离子反应中的离子共存问题,知晓所含8种离子间的反应时解题的基础,本题所给信息较多,要注意整合把握处理.

练习册系列答案
相关题目
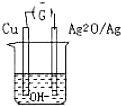 普通水泥在固化过程中自由水分子减少并产生胶体溶液呈碱性.根据这一物理化学特点科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+Ag 下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少并产生胶体溶液呈碱性.根据这一物理化学特点科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+Ag 下列有关说法正确的是( )| A、工业上以黏土、石灰石为主要原料来制造水泥 |
| B、测量原理示意图中 Ag2O为负极 |
| C、负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O |
| D、电池工作时OH-向正极移动 |



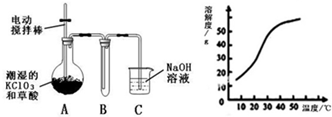 Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.