题目内容
15.常温下,下列各组离子一定能在指定溶液中大量共存的是( )| A. | 含有大量AlO${\;}_{2}^{-}$的溶液中:Na+、OH-、Cl-、CO${\;}_{3}^{2-}$ | |
| B. | 滴加紫色石蕊试液变红的溶液中:K+、Ba2+、CH3COO-、F- | |
| C. | 加入Al能放出H2的溶液中:K+、NH4+、NO3-、HCO3- | |
| D. | 1.0mol?L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
分析 A.溶液显碱性,该组离子之间不反应;
B.滴加紫色石蕊试液变红的溶液,显酸性;
C.加入Al能放出H2的溶液,为非氧化性酸或强碱溶液;
D.离子之间发生氧化还原反应.
解答 解:A.溶液显碱性,该组离子之间不反应,可大量共存,故A正确;
B.滴加紫色石蕊试液变红的溶液,显酸性,酸性溶液中不能大量存在CH3COO-、F-,故B错误;
C.加入Al能放出H2的溶液,为非氧化性酸或强碱溶液,酸溶液中H+、NO3-、Al发生氧化还原反应不生成氢气,碱溶液中不能大量存在NH4+、HCO3-,故C错误;
D.H+、Fe2+、NO3-发生氧化还原反应,不能大量共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
6.设NA表示阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4 L乙烯所含共用电子对数为5NA | |
| B. | 72g Ca02所含离子总数为3NA | |
| C. | 常温下,将1mol Cl2通入到过量的NaOH溶液中,电子转移数目为NA | |
| D. | 1L0.1mol/L Na2C03溶液中,C032-数目为0.lNA |
3.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 某无色溶液:CO32-NO3- Al3+ Ba2+ | |
| B. | 使酚酞变红的溶液:Na+ Cl- SO42-AlO2- | |
| C. | 加入Al能放出H2的溶液中 NH4+、Cl-、Na+、SO42- | |
| D. | 酸性溶液中:NO3-、SO32-、Na+、Fe3+ |
10.下列物质属于混合物的是( )
| A. | 纯碱 | B. | 小苏打 | C. | 烧碱 | D. | 赤铁矿 |
20.某研究性学习小组为探究二氧化硫的还原性,查阅到如表资料:
根据上述资料,请你参与以下探究:
(1)写出铜与浓硫酸反应的化学方程式Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)把足量SO2通入适量的碘水中,可能观察到的现象是溶液棕黄色褪去;
(3)证明SO2被氧化为SO42-所使用的试剂是盐酸和BaCl2溶液;
(4)如果该探究小组想利用上述原理除去CO2中的SO2,并检验是否除尽,下列方案可行的是AB(填字母)
A、将混合气体通过碘水,再通过品红溶液
B、将混合气体通过氯化钡和过氧化氢的混合溶液,再通过碘水溶液
C、将混合气体通过NaOH溶液,再通过品红溶液
D、将混合气体通过浓硫酸溶液,再通过品红溶液
(5)若该探究小组就上述实验提出,把含+4价硫元素化合物转化为含+6价硫元素化合物,下列试剂可以实现上述转化的是ABC(填字母)
A、氧气 B、MnO4- C、氯气 D、浓硫酸.
| 资料卡 NO:2006-KI-001 主题:二氧化硫的还原性 ①课本上:向二氧化硫水溶液中滴加BaCl2溶液,再滴加0.5mL3%的过氧化氢溶液,振荡片刻后滴加稀盐酸,有白色沉淀生成 ②《无机化学》下册,P658:亚硫酸是较强的还原剂,可以将Cl2、I2、MnO4-还原为Cl-、I-、Mn2+,如: H2SO3+I2+H2O═H2SO4+2HI |
(1)写出铜与浓硫酸反应的化学方程式Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)把足量SO2通入适量的碘水中,可能观察到的现象是溶液棕黄色褪去;
(3)证明SO2被氧化为SO42-所使用的试剂是盐酸和BaCl2溶液;
(4)如果该探究小组想利用上述原理除去CO2中的SO2,并检验是否除尽,下列方案可行的是AB(填字母)
A、将混合气体通过碘水,再通过品红溶液
B、将混合气体通过氯化钡和过氧化氢的混合溶液,再通过碘水溶液
C、将混合气体通过NaOH溶液,再通过品红溶液
D、将混合气体通过浓硫酸溶液,再通过品红溶液
(5)若该探究小组就上述实验提出,把含+4价硫元素化合物转化为含+6价硫元素化合物,下列试剂可以实现上述转化的是ABC(填字母)
A、氧气 B、MnO4- C、氯气 D、浓硫酸.
5.硫酸锰可用于饲料营养强氧化剂和媒染剂.其生产原材料软锰矿(MnO2)、菱锰矿(MnCO3)中常混有硫酸亚铁和硫酸镁等杂质,生产工艺如图1:
已知:(1)硫酸锰晶体和硫酸镁晶体的溶解度曲线如图2.(2)完全沉淀离子的pH:Fe3+为3.5,Fe2+为9.5,Mn2+为10.8,Mg2+为l1.6.
下列判断正确的是( )
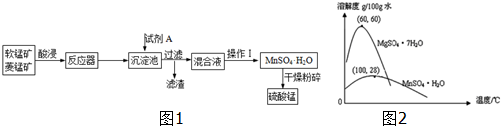
已知:(1)硫酸锰晶体和硫酸镁晶体的溶解度曲线如图2.(2)完全沉淀离子的pH:Fe3+为3.5,Fe2+为9.5,Mn2+为10.8,Mg2+为l1.6.
下列判断正确的是( )

| A. | 试剂A应该选择H2O2,目的是将Fe2+氧化为Fe3+ | |
| B. | 试剂A应该选择氨水,目的是调节溶液的pH | |
| C. | 操作I包括蒸发、冷却、结晶、趁热过滤、洗涤、等步骤,洗涤时可用稀硫酸做洗液 | |
| D. | 在蒸发结晶时,温度应该高于60°C |
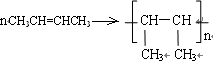
 命名为:3,3-二甲基-1-戊烯;写出该物质与HBr反应的化学方程式:CH3CH2C(CH3)2CH=CH2+HBr→CH3CH2C(CH3)2CHBrCH3
命名为:3,3-二甲基-1-戊烯;写出该物质与HBr反应的化学方程式:CH3CH2C(CH3)2CH=CH2+HBr→CH3CH2C(CH3)2CHBrCH3