题目内容
3.在下列溶液中,各组离子一定能够大量共存的是( )| A. | 某无色溶液:CO32-NO3- Al3+ Ba2+ | |
| B. | 使酚酞变红的溶液:Na+ Cl- SO42-AlO2- | |
| C. | 加入Al能放出H2的溶液中 NH4+、Cl-、Na+、SO42- | |
| D. | 酸性溶液中:NO3-、SO32-、Na+、Fe3+ |
分析 A.碳酸根离子与铝离子、钡离子反应;
B.使酚酞变红的溶液为碱性溶液,溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
C.加入Al能放出H2的溶液中存在电离氢离子或氢氧根离子,铵根离子与氢氧根离子反应;
D.该溶液中存在大量氢离子,亚硫酸根离子与铁离子、氢离子反应.
解答 解:A.CO32-与Al3+、Ba2+之间发生反应,在溶液中不能大量共存,故A错误;
B.使酚酞变红的溶液中存在大量氢氧根离子,Na+、Cl-、SO42-、AlO2-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.加入Al能放出H2的溶液为酸性或强碱性溶液,NH4+与氢氧根离子反应,在碱性溶液中不能大量共存,故C错误;
D.酸性溶液中存在电离氢离子,SO32-与H+、Fe3+之间发生反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
13.工业上生产硫酸最重要的一步是SO2的催化氧化,反应原理如下:2SO2(g)+O2(g)$\stackrel{催化剂}{?}$2SO3(g)△H=-196.6kJ•mol-1;某学生为了模拟上述实验,在体积为10L的密闭容器中充入一定量的SO2与O2并用气体传感器测得不同时刻的SO2与O2的浓度如下表:
试回答:(1)该反应前2min内的平均反应速率υ(O2)=0.004mol•L-1•min-1;
(2)上述反应的平衡常数的表达式为K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$;
(3)上述反应达到平衡时,放出的热量为37.354kJ;
(4)为了提高反应速率和SO2的转化率,下列措施可行的是c(填字母);
a.在容积不变的情况下充入SO2 b.使用更高效的催化剂
c.在容积不变的情况下充入0.2molSO2和0.2molO2 d.升高温度
(5)硫酸工业的尾气是主要大气污染物,有人欲设计利用SO2分解生成S和O2的方法除去SO2,已知:SO2(g)=S(s)+O2(g)△H>0、△S<0,试判断此反应不能(填“能”或“不能”)自发进行,其依据是△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| c(SO2)/mol•L-1 | 0.04 | 0.024 | 0.012 | 0.006 | 0.004 | 0.002 | 0.002 |
| c(O2)/mol•L-1 | 0.04 | 0.032 | 0.026 | 0.023 | 0.022 | 0.021 | 0.021 |
(2)上述反应的平衡常数的表达式为K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$;
(3)上述反应达到平衡时,放出的热量为37.354kJ;
(4)为了提高反应速率和SO2的转化率,下列措施可行的是c(填字母);
a.在容积不变的情况下充入SO2 b.使用更高效的催化剂
c.在容积不变的情况下充入0.2molSO2和0.2molO2 d.升高温度
(5)硫酸工业的尾气是主要大气污染物,有人欲设计利用SO2分解生成S和O2的方法除去SO2,已知:SO2(g)=S(s)+O2(g)△H>0、△S<0,试判断此反应不能(填“能”或“不能”)自发进行,其依据是△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
18.配制100mL 0.1mol/L的NaCl溶液,下列操作会导致所配溶液浓度偏高的是( )
| A. | 称量时,左盘高,右盘低 | B. | 定容时,俯视读取刻度 | ||
| C. | 容量瓶洗净后未干燥 | D. | 定容时,液面超过了刻度线 |
15.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 含有大量AlO${\;}_{2}^{-}$的溶液中:Na+、OH-、Cl-、CO${\;}_{3}^{2-}$ | |
| B. | 滴加紫色石蕊试液变红的溶液中:K+、Ba2+、CH3COO-、F- | |
| C. | 加入Al能放出H2的溶液中:K+、NH4+、NO3-、HCO3- | |
| D. | 1.0mol?L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
12.下列物质的保存方法正确的是( )
①浓硝酸盛放在棕色试剂瓶中
②少量金属钠保存在冷水中
③少量金属钾保存在煤油中
④碳酸钠固体保存在带橡胶塞的细口瓶中
⑤氢氧化钠溶液盛放在带有橡胶塞的试剂瓶中.
①浓硝酸盛放在棕色试剂瓶中
②少量金属钠保存在冷水中
③少量金属钾保存在煤油中
④碳酸钠固体保存在带橡胶塞的细口瓶中
⑤氢氧化钠溶液盛放在带有橡胶塞的试剂瓶中.
| A. | ③④ | B. | ①③⑤ | C. | ①③④ | D. | ③④⑤ |
13.有人设计将两根铂丝做电极插入到KOH溶液中,然后在两极上分别通入甲烷和氧气而构成燃料电池.该电池中反应的化学方程式为CH4+2O2+2KOH═K2CO3+3H2O,则关于此燃料电池的下列说法中错误的是 (已知1个电子所带电量为1.6×10-19C)( )
| A. | 通入甲烷的电极为电池的负极,通入氧气的电极为正极 | |
| B. | 在标准状况下,每消耗5.6 L O2,可向外提供2.4×104 C的电量 | |
| C. | 通入甲烷电极的电极反应为:CH4+10OH--8e-═CO32-+7H2O | |
| D. | 放电一段时间后,溶液的pH减小 |
 铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题: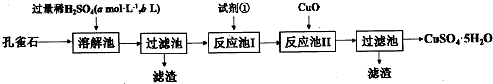
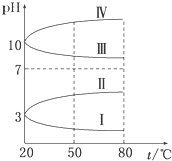 NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题: