题目内容
20.某研究性学习小组为探究二氧化硫的还原性,查阅到如表资料:| 资料卡 NO:2006-KI-001 主题:二氧化硫的还原性 ①课本上:向二氧化硫水溶液中滴加BaCl2溶液,再滴加0.5mL3%的过氧化氢溶液,振荡片刻后滴加稀盐酸,有白色沉淀生成 ②《无机化学》下册,P658:亚硫酸是较强的还原剂,可以将Cl2、I2、MnO4-还原为Cl-、I-、Mn2+,如: H2SO3+I2+H2O═H2SO4+2HI |
(1)写出铜与浓硫酸反应的化学方程式Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)把足量SO2通入适量的碘水中,可能观察到的现象是溶液棕黄色褪去;
(3)证明SO2被氧化为SO42-所使用的试剂是盐酸和BaCl2溶液;
(4)如果该探究小组想利用上述原理除去CO2中的SO2,并检验是否除尽,下列方案可行的是AB(填字母)
A、将混合气体通过碘水,再通过品红溶液
B、将混合气体通过氯化钡和过氧化氢的混合溶液,再通过碘水溶液
C、将混合气体通过NaOH溶液,再通过品红溶液
D、将混合气体通过浓硫酸溶液,再通过品红溶液
(5)若该探究小组就上述实验提出,把含+4价硫元素化合物转化为含+6价硫元素化合物,下列试剂可以实现上述转化的是ABC(填字母)
A、氧气 B、MnO4- C、氯气 D、浓硫酸.
分析 (1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水;
(2)碘单质能够与二氧化硫发生氧化还原反应;
(3)检验硫酸根离子,通常向加入稀盐酸排除干扰,然后加入氯化钡溶液检验;
(4)检验二氧化硫可用品红溶液或碘水,除去二氧化碳中二氧化硫,不能用氢氧化钠溶液,可用双氧水和氯化钡或碘水,据此进行判断;
(5)氧气、高锰酸根离子、氯气都能够氧化二氧化硫,而浓硫酸不能氧化二氧化硫.
解答 解:(1)铜与浓硫酸反应生成硫酸铜、二氧化硫气体和水,反应的化学方程式为:Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)碘单质能够氧化二氧化硫,则把足量SO2通入适量的碘水中溶液棕黄色褪去,
故答案为:溶液棕黄色褪去;
(3)证明SO2被氧化为SO42-,可先用稀盐酸排除干扰离子,然后加入氯化钡溶液,若生成白色沉淀,则证明溶液中含有硫酸根离子,所以选用试剂为盐酸和BaCl2溶液,
故答案为:盐酸和BaCl2溶液;
(4)A.碘单质能够氧化二氧化硫,二氧化碳不与碘单质反应,则将混合气体通过碘水,再通过品红溶液,若品红溶液不褪色,则证明二氧化硫已经除尽,故A正确;
B.将混合气体通过氯化钡和过氧化氢的混合溶液,二氧化硫被氧化成硫酸,硫酸与氯化钡反应生成硫酸钡,从而除去二氧化硫,再通过碘水溶液,若碘水不褪色,则证明二氧化硫已经除尽,故B正确;
C.将混合气体通过NaOH溶液,二氧化碳和二氧化碳都能够与氢氧化钠溶液反应,则不能用氢氧化钠溶液除去二氧化硫,故C错误;
D.将混合气体通过浓硫酸溶液,二氧化碳与二氧化硫都不与浓硫酸反应,则不能用浓硫酸除去二氧化硫,故D错误;
故答案为:AB;
(5)二氧化硫具有还原性,能够被强氧化剂氧化,如氧气、MnO4-、氯气等,但是二氧化硫不与浓硫酸反应,所以满足条件的为ABC,
故答案为:ABC.
点评 本题考查了性质实验方案的设计与评价,题目难度中等,明确二氧化硫的性质为解答关键,注意掌握性质实验方案设计与评价的原则,试题培养了学生的灵活应用能力.

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案①向2mL 0.1mol•L-1 K2Cr2O7溶液中滴入3滴6mol•L-1NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色.
②向2mL 0.1mol•L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72-+14H++6Fe2+?2Cr3+(绿色)+6Fe3++7H2O.下列分析正确的是( )
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O72->Fe3+ | |
| C. | CrO42- 和Fe2+在酸性溶液中可以大量共存 | |
| D. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
| A. | 含有大量AlO${\;}_{2}^{-}$的溶液中:Na+、OH-、Cl-、CO${\;}_{3}^{2-}$ | |
| B. | 滴加紫色石蕊试液变红的溶液中:K+、Ba2+、CH3COO-、F- | |
| C. | 加入Al能放出H2的溶液中:K+、NH4+、NO3-、HCO3- | |
| D. | 1.0mol?L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| A. | ④②①③ | B. | ①④③② | C. | ②③①④ | D. | ②④①③ |
①浓硝酸盛放在棕色试剂瓶中
②少量金属钠保存在冷水中
③少量金属钾保存在煤油中
④碳酸钠固体保存在带橡胶塞的细口瓶中
⑤氢氧化钠溶液盛放在带有橡胶塞的试剂瓶中.
| A. | ③④ | B. | ①③⑤ | C. | ①③④ | D. | ③④⑤ |
| A. | 液氨是非电解质,但液态氯化氢是强电解质 | |
| B. | 体积不同但pH相同的醋酸和盐酸,用蒸馏水分别稀释至原体积的m倍和n倍后两溶液的pH值仍相同,m和n的相对大小无法确定 | |
| C. | CuCl2+2H2O═Cu(OH)2+2HCl,加入少量硝酸银固体后可以增大CuCl2水解程度 | |
| D. | I-、K+、Na+、NO3-、Cl-一定可以在甲基橙呈黄色的溶液中大量共存 |
| A. | 已知FeO4n-中Fe的化合价是+6价,则n=2 | |
| B. | 每产生1molCl-,转移2mol电子 | |
| C. | FeO4n-具有强氧化性,一般其还原产物为Fe3+,可用作新型自来水消毒剂和净水剂 | |
| D. | 若n=2,则该反应中氧化剂与还原剂的物质的量之比为2:3 |
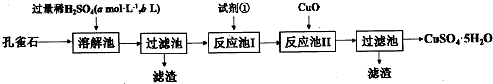
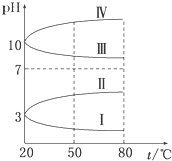 NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题: