题目内容
20.下列反应的离子方程式正确的是( )| A. | 过氧化钠与水反应:2O22-+2H2O═O2↑+4OH- | |
| B. | NaOH溶液与NH4Cl溶液共热:OH-+NH4+$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | Cl2与水反应:Cl2+H2O═Cl-+ClO-+2H+ | |
| D. | FeCl3溶液刻蚀铜电路板:Fe3++Cu═Cu2++Fe2+ |
分析 A.过氧化钠在离子反应中保留化学式;
B.反应生成氯化钠、氨气和水;
C.反应生成的HClO在离子反应中保留化学式;
D.电子、电荷守恒.
解答 解:A.过氧化钠与水反应的离子反应为2Na2O2+2H2O═O2↑+4Na++4OH-,故A错误;
B.NaOH溶液与NH4Cl溶液共热的离子反应为OH-+NH4+$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,故B正确;
C.Cl2与水反应的离子反应为Cl2+H2O═Cl-+HClO+H+,故C错误;
D.FeCl3溶液刻蚀铜电路板的离子反应为2Fe3++Cu═Cu2++2Fe2+,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应、与量有关的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
11.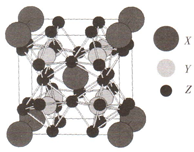 某种能实现热电效应的晶体的晶胞模型如右图.已知晶胞的六个面的原子数相同,Y原子位于Z原子围成的八面体中心.下列说法正确的是( )
某种能实现热电效应的晶体的晶胞模型如右图.已知晶胞的六个面的原子数相同,Y原子位于Z原子围成的八面体中心.下列说法正确的是( )
 某种能实现热电效应的晶体的晶胞模型如右图.已知晶胞的六个面的原子数相同,Y原子位于Z原子围成的八面体中心.下列说法正确的是( )
某种能实现热电效应的晶体的晶胞模型如右图.已知晶胞的六个面的原子数相同,Y原子位于Z原子围成的八面体中心.下列说法正确的是( )| A. | 距离X最近的Y原子有8个 | B. | 距离X最近的X原子有6个 | ||
| C. | 距离X最近的Z原子有3个 | D. | 该晶体的化学式为X2Y8Z12 |
12.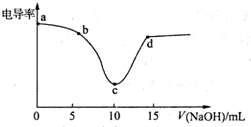 利用电导率传感器可绘制电导率曲线图,下图为用0.1mol•L-1NaOH溶液滴定10mL,0.1mol•L-1盐酸过程中的电导率曲线.下列说法错误的是( )
利用电导率传感器可绘制电导率曲线图,下图为用0.1mol•L-1NaOH溶液滴定10mL,0.1mol•L-1盐酸过程中的电导率曲线.下列说法错误的是( )
 利用电导率传感器可绘制电导率曲线图,下图为用0.1mol•L-1NaOH溶液滴定10mL,0.1mol•L-1盐酸过程中的电导率曲线.下列说法错误的是( )
利用电导率传感器可绘制电导率曲线图,下图为用0.1mol•L-1NaOH溶液滴定10mL,0.1mol•L-1盐酸过程中的电导率曲线.下列说法错误的是( )| A. | 电导率传感器能用于判断酸碱中和滴定的终点 | |
| B. | 该过程中,a点所示溶液的导电性最强 | |
| C. | c点电导率最小是因为此时溶液中导电微粒的数目最少 | |
| D. | d点所示溶液中存在:c(Cl-)+c(OH-)=c(H+)+c(Na+) |
8.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 常温下在强碱性的溶液中:Na+、Ba2+、Cl-、NO3- | |
| B. | 能使紫色石蕊试液变蓝的溶液中:Ca2+、Fe2+、AlO2-、Cl- | |
| C. | 与铝反应产生无色无气味气体的溶液中:Na+、K+、HCO3-、SO42- | |
| D. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
15.可以用SO42-+Ba2+═BaSO4↓表示的离子反应为( )
| A. | 稀硫酸与氧氧化钡溶液反应 | B. | 稀硫酸与氯化钡溶液反应 | ||
| C. | 稀硫酸与碳酸钡反应 | D. | 硫酸氢钠溶液与氢氧化坝溶液反应 |
12.下列说法错误的是( )
| A. | 浓硝酸与足量铜片反应时,先生成红棕色气体,后生成无色气体 | |
| B. | 浓硫酸具有强氧化性,常温下可将铝的单质氧化,因此,不能用铝罐车运输浓硫酸 | |
| C. | 饱和氯水既有酸性又有漂白性,加入NaHCO₃后漂白性减弱 | |
| D. | 浓盐酸与足量二氧化锰反应后,盐酸有剩余 |
9.在一定条件下,在体积为VL的密闭容器中发生反应:mA+nB?pC.t秒末,A减少了1mol,B减少了1.25mol,C增加了0.5mol.则m:n:p应为( )
| A. | 4:5:2 | B. | 2:5:4 | C. | 1:3:2 | D. | 3:2:1 |

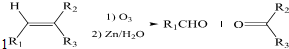

 +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O.
+H2O. .
. (写出其中一种的结构简式).
(写出其中一种的结构简式).
 .
.