题目内容
15.可以用SO42-+Ba2+═BaSO4↓表示的离子反应为( )| A. | 稀硫酸与氧氧化钡溶液反应 | B. | 稀硫酸与氯化钡溶液反应 | ||
| C. | 稀硫酸与碳酸钡反应 | D. | 硫酸氢钠溶液与氢氧化坝溶液反应 |
分析 能用离子方程式Ba2++SO42-═BaSO4↓表示的反应应是可溶性钡盐或氢氧化钡与可溶性硫酸盐或硫酸反应,没有其它离子参加反应,据此进行判断.
解答 解:A.硫酸溶液与氢氧化钡溶液反应的离子方程式为:Ba2++2OH-+2H++SO42-═2H20+BaSO4↓,不能用SO42-+Ba2+═BaSO4↓表示,故A错误;
B.稀硫酸与氯化钡溶液反应生成硫酸钡和硫化氢,反应的离子方程式为Ba2++SO42-═BaSO4↓,故B正确;
C.碳酸钡为难溶物,离子方程式中需要保留化学式,离子方程式不能用SO42-+Ba2+═BaSO4↓表示,故C错误;
D.硫酸氢钠与氢氧化钡溶液反应生成硫酸钡和水,若氢氧化钡过量,反应的离子方程式为:Ba2++2OH-+2H++SO42-═2H20+BaSO4↓,不能用SO42-+Ba2+═BaSO4↓表示,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,题目难度中等,明确离子方程式的书写原则为解答关键,注意掌握离子方程式表示意义,试题培养了学生的分析、理解能力及规范答题能力.

练习册系列答案
相关题目
7.将铜和氧化铁的混和物溶于足量稀盐酸中,向所得溶液中滴入2滴KSCN溶液后出现红色.下列有关说法错误的是( )
| A. | 容器中可能有固体残渣 | B. | 所得溶液中一定存在Fe2+ | ||
| C. | 反应过程中水的电离程度增大 | D. | 再加入铜后,溶液红色逐渐退去 |
10.以下实验操作正确的是( )
| A. | 用燃着的酒精灯去点燃另一个酒精灯 | |
| B. | 用托盘天平称量氢氧化钠固体时,托盘里应该垫上纸进行称量 | |
| C. | 蒸发某溶液,待溶液中有大量晶体析出时即停止加热 | |
| D. | 浓硫酸稀释时,沿着烧杯壁将水慢慢加如到浓硫酸中,边加边搅拌 |
20.下列反应的离子方程式正确的是( )
| A. | 过氧化钠与水反应:2O22-+2H2O═O2↑+4OH- | |
| B. | NaOH溶液与NH4Cl溶液共热:OH-+NH4+$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | Cl2与水反应:Cl2+H2O═Cl-+ClO-+2H+ | |
| D. | FeCl3溶液刻蚀铜电路板:Fe3++Cu═Cu2++Fe2+ |
7.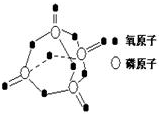 研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:
已知白磷的燃烧热为2378.0kJ/mol,白磷完全燃烧的产物结构如图所示,则上表中X= kJ•mol-1.( )
 研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
| A. | 1057.5 kJ•mol-1 | B. | 335.25 kJ•mol-1 | C. | 433.75 kJ•mol-1 | D. | 959.0 kJ•mol-1 |
5.某无色溶液中一定能大量共存的离子组是( )
| A. | Cu2+、Na+、NO3-、SO42- | B. | Ba2+、NH4+、Cl-、SO42- | ||
| C. | Na+、K+、ClO-、SO42- | D. | H+、Na+、I-、NO3- |
 (1)某煤化工产业链的一部分发生某一反应,
(1)某煤化工产业链的一部分发生某一反应, (用电子式表示).
(用电子式表示).