题目内容
12.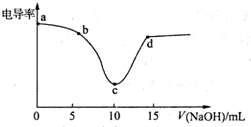 利用电导率传感器可绘制电导率曲线图,下图为用0.1mol•L-1NaOH溶液滴定10mL,0.1mol•L-1盐酸过程中的电导率曲线.下列说法错误的是( )
利用电导率传感器可绘制电导率曲线图,下图为用0.1mol•L-1NaOH溶液滴定10mL,0.1mol•L-1盐酸过程中的电导率曲线.下列说法错误的是( )| A. | 电导率传感器能用于判断酸碱中和滴定的终点 | |
| B. | 该过程中,a点所示溶液的导电性最强 | |
| C. | c点电导率最小是因为此时溶液中导电微粒的数目最少 | |
| D. | d点所示溶液中存在:c(Cl-)+c(OH-)=c(H+)+c(Na+) |
分析 A.HCl和NaOH反应方程式为HCl+NaOH=NaCl+H2O,根据图象知,从0-10mL之间,随着反应的进行,溶液中c(H+)浓度逐渐减小,溶液的电导率逐渐降低,加入溶液体积大于15mL时,溶液中氢氧根离子浓度逐渐增大,溶液的电导率增大,根据图知,当恰好中和时电导率最小;
B.电导率与导电性成正比;
C.溶液电导率与离子浓度成正比,c点电导率低是因为离子浓度小;
D.任何电解质溶液中都存在电荷守恒.
解答 解:A.HCl和NaOH反应方程式为HCl+NaOH=NaCl+H2O,根据图象知,从0-10mL之间,随着反应的进行,溶液中c(H+)浓度逐渐减小,溶液的电导率逐渐降低,加入溶液体积大于15mL时,溶液中氢氧根离子浓度逐渐增大,溶液的电导率增大,根据图知当恰好中和时电导率最小,所以可以电导率传感器能用于酸碱中和滴定终点的判断,故A正确;
B.电导率与导电性成正比,根据图知该点电导率最大,所以其导电性最强,故B正确;
C.溶液电导率与离子浓度成正比,c点电导率低是因为离子浓度小,而不是导电微粒数目最少,故C错误;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Cl-)+c(OH-)=c(H+)+c(Na+),故D正确;
故选C.
点评 本题以电解质溶液的导电性为载体考查酸碱混合溶液定性判断,明确反应实质、电导率的影响因素及混合溶液中溶质是解本题关键,会根据图象中曲线变化获取信息、加工信息,从而利用信息答题,注意电解质溶液中电荷守恒与溶液酸碱性无关、与溶液浓度无关,为易错点.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
2.2015年12月12日,参加巴黎气候大会的近200个缔约方的代表们通过了一份旨在限制温室气体排放的国际会议,中国为推动达成该协议作出了建设性贡献.下列工业生产中涉及到的化学反应不直接产生温室气体的是( )
| A. | 用焦炭在电炉中还原二氧化硅制取硅单质 | |
| B. | 用煤炭作燃料发电 | |
| C. | 用铁矿石炼铁 | |
| D. | 用纯碱制玻璃 |
3.下列变化需加入氧化剂才可实现的是( )
| A. | CO→CO2 | B. | CO2→Na2CO3 | C. | NO2→HNO3 | D. | S→CuS |
7.将铜和氧化铁的混和物溶于足量稀盐酸中,向所得溶液中滴入2滴KSCN溶液后出现红色.下列有关说法错误的是( )
| A. | 容器中可能有固体残渣 | B. | 所得溶液中一定存在Fe2+ | ||
| C. | 反应过程中水的电离程度增大 | D. | 再加入铜后,溶液红色逐渐退去 |
17.下列物质的分子中的所有原子一定在同一平面上的是( )
| A. | CH3-CH=CH2 | B. | CH2=CH2 | C. | C2H6 | D. | C6H6 |
20.下列反应的离子方程式正确的是( )
| A. | 过氧化钠与水反应:2O22-+2H2O═O2↑+4OH- | |
| B. | NaOH溶液与NH4Cl溶液共热:OH-+NH4+$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | Cl2与水反应:Cl2+H2O═Cl-+ClO-+2H+ | |
| D. | FeCl3溶液刻蚀铜电路板:Fe3++Cu═Cu2++Fe2+ |
 甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇. (用电子式表示).
(用电子式表示).