题目内容
18.粗盐中含有不溶性泥沙,可溶性的CaCl2、MgCl2以及一些硫酸盐等.精制食盐水的实验操作顺序如下:①加入过量BaCl2溶液,②加入过量NaOH溶液,③加入过量Na2CO3溶液,④过滤,⑤加入适量盐酸.下列说法不正确的是( )| A. | ①②③中加入过量的试剂是为了完全除去相应的杂质离子 | |
| B. | ③中加入过量Na2CO3溶液仅为了完全除去Ca2+ | |
| C. | 因为Mg(OH)2难溶而MgCO3微溶,所以用NaOH除Mg2+效果比用Na2CO3好 | |
| D. | ⑤中可以通过边滴加边测定溶液pH的方法,控制加入的盐酸“适量” |
分析 从电离的角度分析粗盐中的杂质可知:溶液中的杂质离子为钙离子、镁离子、和硫酸根离子,硫酸根离子用钡离子沉淀,根据镁离子用氢氧根离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析.
解答 解:A.①加入过量BaCl2溶液,可除掉硫酸根离子,②加入过量NaOH溶液,可除掉镁离子,③加入过量Na2CO3溶液,可除掉钙离子,故A正确;
B.加碳酸钠要放在加氯化钡之后,③中加入过量Na2CO3溶液不仅为了完全除去Ca2+,还可以将过量的钡离子沉淀,故B错误;
C.因为Mg(OH)2难溶而MgCO3微溶,所以用NaOH除Mg2+效果比用Na2CO3好,故C正确;
D.⑤中可以通过边滴加边测定溶液pH的方法,在除掉碳酸根、氢氧根后,得到氯化钠溶液,呈中性,只要控制加入的盐酸“适量”,就能达到目的,故D正确;
故选B.
点评 除杂问题是化学实验中的一类重要问题,除杂时不仅要能把杂质除掉,还不能引入新杂质,而且方法要简便易行,把握好此原则需要我们有扎实的基础知识和缜密的思维.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列结论正确的是
①微粒半径:S2->Cl->F ②氢化物的稳定性:HF>HCl>H2S>H2Te
③离子的还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4 ⑥非金属性:F>Cl>S>Se( )
①微粒半径:S2->Cl->F ②氢化物的稳定性:HF>HCl>H2S>H2Te
③离子的还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4 ⑥非金属性:F>Cl>S>Se( )
| A. | ①②④⑥ | B. | ①③④ | C. | ①③ | D. | ⑤⑥ |
9.有机物 的一氯代物的同分异构体有几种?( )
的一氯代物的同分异构体有几种?( )
 的一氯代物的同分异构体有几种?( )
的一氯代物的同分异构体有几种?( )| A. | 7 | B. | 8 | C. | 9 | D. | 10 |
6.下列化合物不属于有机物的是( )
| A. | CH3CH2OH | B. | CH3COOH | C. | CH3COOCH3 | D. | CO2 |
3.下列说法正确的是( )
| A. | 非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价 | |
| B. | 只有非金属元素才能形成含氧酸盐 | |
| C. | 主族元素中的金属元素形成的最高价阳离子一定与上一周期稀有气体元素的原子核外电子排布相同 | |
| D. | 非金属元素的最高价含氧酸都具有强氧化性 |
7.下面有关晶体的叙述中,正确的是( )
| A. | 金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有4个碳原子 | |
| B. | 12 g石墨中含有4NA个C-C键 | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 干冰晶体中,每个CO2分子周围紧邻6个CO2分子 |
8.已知723K时,2S02(g)+02(g)?2S02(g)△H=-Q,在相同条件下,向一密闭容器中通入2molS02和1mol02,达到平衡时放出的热量为Q1;向另一体积相同的密闭容器中通入1molS02和0.5mol02,达到平衡时放出的热量为Q2.则Q1、Q2、Q满足的关系是( )
| A. | Q>Q1>2Q2 | B. | Q2<Q1<2Q2 | C. | Q=Q1>Q2 | D. | Q1=2Q2 |
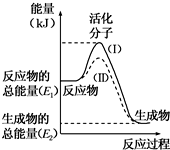 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.