题目内容
14.硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分有SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%.某学生探究性学习小组的同学设计了下列的方案,用化学基本知识进行金属元素的提取实验(已知:25℃氢氧化镁Ksp=5.6×10-12;氢氧化铁Ksp=3.5×10-38;氨水的电离常数K=1.8×10-5,饱和氨水的pH约为11)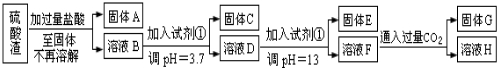
请回答下列问题:
(1)写出固体A的化学式:SiO2.
(2)上述各步,分离得到固体和溶液的实验操作是过滤,要将固体C、固体E和固体G都转化为相应的稳定的氧化物,需进行的实验操作为灼烧(加热).
(3)上述两步需加入试剂①调节pH,试剂①为A(填编号)
A.NaOH溶液 B.氨水C.水 D.硝酸
(4)溶液F中通入过量CO2的离子方程式为AlO2-+CO2+2H2O=Al(OH)3+2 HCO3-.
(5)若不考虑溶液体积的变化,请计算溶液D调节到pH=13后,溶液中c(Mg2+)=5.6×10-10mol•L-1.
分析 硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,氧化铁、氧化铝、氧化镁和盐酸反应,所以溶液B的溶质是氯化镁、氯化铁、氯化铝、盐酸(过量);向溶液B中加试剂①并调节溶液的pH值为3.7,结合题意溶液pH=3.7时Fe3+已经沉淀完全知,试剂①是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂①只能是强碱溶液,固体C是氢氧化铁;向溶液D中加入试剂①并调节溶液的pH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,所以固体E是氢氧化镁;溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,所以G是氢氧化铝.
(1)固体A为难溶于盐酸的二氧化硅;
(2)分离得到固体和溶液的实验操作是过滤,将沉淀转化为相应的稳定的氧化物,需灼烧(加热);
(3)试剂①是强碱溶液;
(4)溶液F中通入过量CO2,NaAlO2溶液和过量的CO2反应生成氢氧化铝和碳酸氢钠;
(5)根据氢氧化镁Ksp=5.6×10-12来计算.
解答 解:(1)硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,化学式为:SiO2,
故答案为:SiO2;
(2)分离得到固体和溶液的实验操作是过滤,固体C是氢氧化铁,固体E是氢氧化镁,固体G是氢氧化铝,加热均可分解得到对应的氧化物,
故答案为:过滤 灼烧(加热);
(3)试剂①是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂①只能是强碱溶液,
故选:A;
(4)NaAlO2溶液中通入过量的CO2反应生成氢氧化铝和碳酸氢钠,离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3+2 HCO3-;
(5)因溶液的pH值为13,c(OH-)=10-1mol•L-1,Ksp=c(Mg2+)×c2(OH-)=c(Mg2+)×10-2=5.6×10-12,所以c(Mg2+)=5.6×10-10 mol•L-1,
故答案为:5.6×10-10.
点评 本题考查了物质的分离、提纯的方法选择及应用,题目难度中等,明确各物质的性质是解本题的关键,本题注意溶度积的相关计算.

| A. | CO2为V形的极性分子 | |
| B. | SO2与O3互为等电子体 | |
| C. | NaCl的晶格能高于KCl | |
| D. | 第一电离能由高到低的顺序为:F>O>N |
| A. | 1:2 | B. | 1:5 | C. | 1:10 | D. | 10:1 |

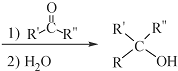
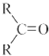 $\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$
$\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$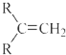 (R表示烃基,R′和R″表示烃基或氢)
(R表示烃基,R′和R″表示烃基或氢)  .写出A中含氧官能团的名称:羟基
.写出A中含氧官能团的名称:羟基 或
或 .(不考虑环状结构)
.(不考虑环状结构) .
.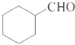 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH.
 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示)
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示)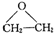 ,该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$
,该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$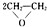 .
.