题目内容
2.从图表中获得有用的信息是化学学习和研究的重要能力.(1)已知600℃时,在2L密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)?2SO3(g)
△H=-197kJ•mol-1反应过程中SO2、O2、SO3物质的量变化如图1所示.
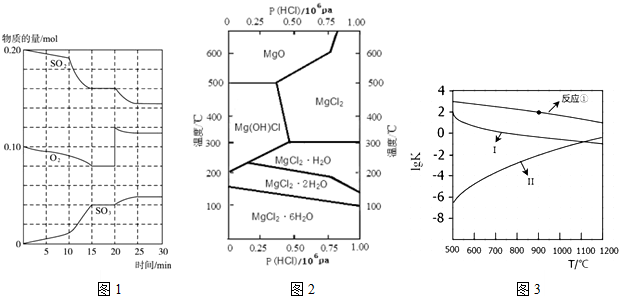
①反应开始到20min时,用SO3表示的反应平均速率为0.001mol•L-1•min-1.
②10min、15min、20min曲线均出现拐点,10min时曲线变化的原因可能是AE(填选项标号);
20min时,曲线发生变化是因为C(填选项标号).
A.升高温度 B.降低压强 C.加入氧气 D.加入SO3E.加入催化剂
③下列描述能说明该反应达到平衡状态的是BD.
A.混合气体的总质量不随时间的变化而变化
B.SO2的转化率达到最大,且保持不变
C.化学反应速率v(O2)=“v“(SO3)
D.保持温度和容积不变,混合气体的总压强不随时间的变化而变化
(2)温度与HCl压强对MgCl2•6H2O受热分解产物的影响如2图所示,下列说法正确的是AD
A.温度低于100℃,MgCl2•6H2O不会发生分解
B.要得到MgO温度至少需要加热至600℃
C.要得到无水MgCl2只要控制温度,不一定要在HCl气体中
D.在HCl气体压强为0.25×106Pa时,温度由室温升高至300℃,发生的反应为MgCl2•6H2O=Mg(OH)Cl
+HCl+5H2O
(3)用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
①$\frac{1}{4}$CaSO4(s)+CO(g)?$\frac{1}{4}$CaS(s)+CO2(g)△H1=-47.3kJ/mol
②CaSO4(s)+CO(g)?CaO(s)+CO2(g)+SO2(g)△H2=+210.5kJ/mol
③CO(g)?$\frac{1}{2}$C(s)+$\frac{1}{2}$CO2(g)△H3=-86.2kJ/mol
反应①-③的平衡常数的对数lgK随反应温度T的变化曲线见图3,结合各反应的△H,归纳lgK-T曲线变化规律:(a)当△H>0时,lgK随温度升高而增大,当△H<0时,lgK随温度升高而减小;(b)当温度同等变化时,△H的数值越大lgK的变化越大(或△H的数值越大,lgK随温度的变化程度越大).
分析 (1)①由图可知,反应进行至20min时,根据v=$\frac{△c}{△t}$计算;
②由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变;由图可知,反应进行至20min时,改变体积,平衡向正反应移动,瞬间只有氧气的浓度增大;
③当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,据此分析解答该题;
(2)A.由图可知温度低于100℃,MgCl2•6H2O不会发生分解;
B.由图可知P(HCl)g=0.25MPa,温度从300℃升高到500℃时MgCl2•6H2O晶体由Mg(OH)Cl转变成MgO;
C.加热MgCl2•6H2O晶体,P(HCl)g较小,镁离子水解生成氢氧化镁,得不到氯化镁,若要得到无水氯化镁,则应通入HCl,而增大P(HCl)g,抑制镁离子的水解;
D.由图可知在HCl气体压强为0.25×106Pa时,温度由室温升高至300℃,发生的反应为MgCl2•6H2O═Mg(OH)Cl+HCl+5H2O;
(3)根据反应①-③的平衡常数的对数lgK随反应温度T的变化曲线进行判断变化规律.
解答 解:(1)①由图可知,反应进行至20min时,SO3的物质的量变化为0.04mol,则反应平均速率为:v=$\frac{\frac{0.04mol}{2L}}{20}$=0.001mol•L-1•min-1,
故答案为:0.001mol•L-1•min-1;
②由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变,所以改变的条件即为增大反应速率,可选AE;
由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大,应是增大了氧气的浓度,所以选C,
故答案为:AE;C;
③A.反应前后气体的总质量一直不变,所以总质量不再变化不能说明达到了平衡状态,故A错误;
B.SO2的转化率达到最大,且保持不变,说明达到了平衡状态,故B正确;
C.没有指明正逆反应速率,不能说明达到了平衡状态,故C错误;
D.反应物和生成物中气体的计量数之和不等,容器中压强不变,能证明达到了平衡状态,故D正确;
故答案为:BD;
(2)A.由图可知温度低于100℃,MgCl2•6H2O不会发生分解,故A正确;
B.由图可知P(HCl)g=0.25MPa,温度从300℃升高到500℃时MgCl2•6H2O晶体由Mg(OH)Cl转变成MgO,故B错误;
C.加热MgCl2•6H2O晶体,P(HCl)g较小,镁离子水解生成氢氧化镁,得不到氯化镁,若要得到无水氯化镁,则应通入HCl,而增大P(HCl)g,抑制镁离子的水解,故C错误;
D.由图可知在HCl气体压强为0.25×106Pa时,温度由室温升高至300℃,发生的反应为MgCl2•6H2O═Mg(OH)Cl+HCl+5H2O,故D正确;
故答案为:AD;
(3)根据图象曲线变化可知,反应①、③为放热反应,随着温度的升高,平衡常数K逐渐减小,则lgK逐渐减小,而反应②为吸热反应,升高温度,平衡常数K逐渐增大,则lgK逐渐增大,所以Ⅰ表示的为反应③、Ⅱ曲线表示的为反应②,变化规律为:当△H>0时,lgK随温度升高而增大,当△H<0时,lgK随温度升高而减小;根据反应①和曲线Ⅰ(反应③反应)的反应热可知,当温度同等变化时,△H的数值越大lgK的变化越大,
故答案为:当△H>0时,lgK随温度升高而增大,当△H<0时,lgK随温度升高而减小;当温度同等变化时,△H的数值越大lgK的变化越大;(或△H的数值越大,lgK随温度的变化程度越大).
点评 本题考查较为综合,涉及物质的量随时间变化的曲线、化学平衡及其影响、化学平衡状态的判断等知识,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用能力.

 快捷英语周周练系列答案
快捷英语周周练系列答案
| A. | 离子半径:X>Y>Z | |
| B. | WX3和水反应形成的化合物是离子化合物 | |
| C. | 最高价氧化物对应的水化物酸性:R>W | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4
④还原性:I->Br->Cl-.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
| A. | 甲烷、乙烯、丙烯 | B. | 苯、甲苯、二甲苯 | C. | 甲醇、乙醇、苯酚 | D. | 己烯、苯、苯酚 |
| A. | VA=3.0mol•L-1•min-1 | B. | VB=0.2mol•L-1•s-1 | ||
| C. | VC=4.8mol•L-1•min-1 | D. | VD=4.0mol•L-1•min-1 |
 生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.
生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.(1)已知:①2CH3OH(l)+3O2(g)﹦2CO2(g)+4H2O(g)△H=-1275.6KJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0KJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(2)由生物质能获得的CO和H2,可以合成多种有机物.当CO和H2以物质的量之比1:1进行催化反应,其原子利用率达100%,合成的物质可能是cd
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.
①下列对该反应的有关说法不正确的是a
a.当v(CO)=2v(H2)时,该反应处于平衡状态
b.恒温恒压下,容器内气体的密度不再改变时,表明反应达到平衡状态
c.在原平衡体系中充入一定量的氦气,平衡可能发生移动
d.恒温恒压下,改变反应物的投入量,△H的值不发生变化
e.温度一定时,缩小容器的体积,平衡将向右移动,c(CO)将变大
②若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH平衡时浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | a1 | a2 | a3 |
a.c3>2c1=2c2
b.Q1+Q2=90.8 Q3=2Q1
c.K1=K2=K3
d.a2+a3<100%
(4)CO和H2催化合成二甲醚的反应为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),一定温度下,在1L密闭容器中充入3molH2和3molCO进行反应,若用po表示该体系开始时的总压强,p表示平衡时的总压强,则平衡时CO的转化率为$\frac{3(p-{p}_{0})}{2{p}_{0}}$×100%(用po、p的式子表示)
(5)如图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为(CH3)2O-12e-+3H2O=2CO2+12H+.
| 选项 | A | B | C | D |
| n(CO2)(mol) | 6 | 4 | 3 | 2 |
| n(沉淀)(mol) | 2 | 3 | 2 | 1 |
| A. | A | B. | B | C. | C | D. | D |
