题目内容
19.若不考虑空气等因素的影响,试计算:(1)将10g铁粉加入到50mL 2mol•L-1的稀硫酸中,充分反应后生成的硫酸亚铁物质的量为0.1mol.
(2)将a g生铁(成分是Fe和C)加入到b mL 2mol•L-1的稀硫酸中,充分反应后生成的氢气c L(标准状况),溶液中有黑色固体剩余.再加入少量稀硫酸,黑色固体不溶解,则生铁中的质量分数是$\frac{2.5c}{a}$(用代数式表示).
(3)将a g处理过的废铁屑(成分是Fe和Fe2O3)加入到b mL 2mol•L-1的稀硫酸中,生成的氢气c L(标准状况).充分反应后生成硫酸亚铁的物质的量取值范围为:$\frac{c}{22.4}$mol<n(FeSO4)≤2b×10-3mol(用代数式表示).
分析 (1)n(Fe)=$\frac{10g}{56g/mol}$=0.179mol,n(H2SO4)=2mol/L×0.05L=0.1mol,二者反应方程式为Fe+H2SO4=FeSO4+H2↑,根据方程式知,Fe过量,以硫酸为标准计算硫酸亚铁的物质的量;
(2)充分反应后生成的氢气c L(标准状况),溶液中有黑色固体剩余.再加入少量稀硫酸,黑色固体不溶解,说明Fe完全反应,根据Fe+H2SO4=FeSO4+H2↑得m(Fe)=n(Fe).M(Fe)=n(H2).M(Fe)=$\frac{c}{22.4}$mol×56g/mol,Fe的质量分数=$\frac{m(Fe)}{m(生铁)}×100%$;
(3)生成硫酸亚铁最少时为Fe和硫酸反应生成氢气,Fe和硫酸铁不反应;生成硫酸亚铁最多时为硫酸根离子完全与亚铁离子结合生成硫酸亚铁,所以生成硫酸亚铁的物质的量大于产生氢气生成的硫酸亚铁的量,小于等于硫酸完全转化为硫酸亚铁的物质的量.
解答 解:(1)n(Fe)=$\frac{10g}{56g/mol}$=0.179mol,n(H2SO4)=2mol/L×0.05L=0.1mol,二者反应方程式为Fe+H2SO4=FeSO4+H2↑,根据方程式知,Fe过量,以硫酸为标准得n(FeSO4)=n(H2SO4)=0.1mol,
故答案为:0.1mol;
(2)充分反应后生成的氢气c L(标准状况),溶液中有黑色固体剩余.再加入少量稀硫酸,黑色固体不溶解,说明Fe完全反应,根据Fe+H2SO4=FeSO4+H2↑得m(Fe)=n(Fe).M(Fe)=n(H2).M(Fe)=$\frac{c}{22.4}$mol×56g/mol,Fe的质量分数=$\frac{m(Fe)}{m(生铁)}×100%$=$\frac{\frac{c}{22.4}mol×56g/mol}{ag}$×100%=$\frac{2.5c}{a}$,
故答案为:$\frac{2.5c}{a}$;
(3)生成硫酸亚铁最少时为Fe和硫酸反应生成氢气,Fe和硫酸铁不反应;生成硫酸亚铁最多时为硫酸根离子完全与亚铁离子结合生成硫酸亚铁,根据Fe+H2SO4=FeSO4+H2↑,则FeSO4~H2↑,所以n(FeSO4)=n(H2)=$\frac{cL}{22.4L/mol}$=$\frac{c}{22.4}$mol,小于等于硫酸完全转化为硫酸亚铁的物质的量,根据硫酸根守恒可知:n(FeSO4)=b×10-3L×2mol/L=2b×10-3mol,所以$\frac{c}{22.4}$mol<n(FeSO4)≤2b×10-3mol,故答案为:$\frac{c}{22.4}$mol;2b×10-3mol.
点评 本题考查化学方程式的计算,为高频考点,侧重考查学生分析计算能力,难点是(3)题的取值范围的计算,把握哪种情况生成的硫酸亚铁最少、哪种情况生成的硫酸亚铁最多是解本题关键,题目难度中等.

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案| A. | 甲烷、乙烯、丙烯 | B. | 苯、甲苯、二甲苯 | C. | 甲醇、乙醇、苯酚 | D. | 己烯、苯、苯酚 |
 生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.
生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.(1)已知:①2CH3OH(l)+3O2(g)﹦2CO2(g)+4H2O(g)△H=-1275.6KJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0KJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(2)由生物质能获得的CO和H2,可以合成多种有机物.当CO和H2以物质的量之比1:1进行催化反应,其原子利用率达100%,合成的物质可能是cd
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol.
①下列对该反应的有关说法不正确的是a
a.当v(CO)=2v(H2)时,该反应处于平衡状态
b.恒温恒压下,容器内气体的密度不再改变时,表明反应达到平衡状态
c.在原平衡体系中充入一定量的氦气,平衡可能发生移动
d.恒温恒压下,改变反应物的投入量,△H的值不发生变化
e.温度一定时,缩小容器的体积,平衡将向右移动,c(CO)将变大
②若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH平衡时浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | a1 | a2 | a3 |
a.c3>2c1=2c2
b.Q1+Q2=90.8 Q3=2Q1
c.K1=K2=K3
d.a2+a3<100%
(4)CO和H2催化合成二甲醚的反应为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),一定温度下,在1L密闭容器中充入3molH2和3molCO进行反应,若用po表示该体系开始时的总压强,p表示平衡时的总压强,则平衡时CO的转化率为$\frac{3(p-{p}_{0})}{2{p}_{0}}$×100%(用po、p的式子表示)
(5)如图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为(CH3)2O-12e-+3H2O=2CO2+12H+.
| A. | 铁原子的电子排布式:[Ar]3d64s2 | B. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | ||
| C. | 氢氧化钠的电子式: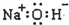 | D. | F的原子结构示意图: |
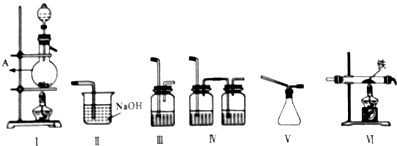
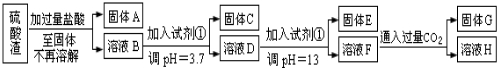
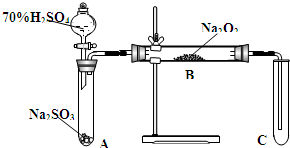 类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用如图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.
类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用如图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.