题目内容
 天然气在工农业生产中具有重要意义.
天然气在工农业生产中具有重要意义.(1)工业上用CH4和H2O(g)为原料合成新型燃料--甲醚(CH3OCH3)的有关反应如下:Ⅰ.CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+216kJ?mol-1
Ⅱ.CO(g)+2H2(g)?CH3OH(g)△H2=-90.7kJ?mol-1
Ⅲ.2CH3OH(g)?CH3OCH3(g)+H2O(g)△H3=-23.5kJ?mol-1
试计算反应2CH4(g)+H2O(g)?CH3OCH3(g)+2H2(g)的△H=
a.升高温度 b.充人Ar c.使用催化剂 d.再充人一定量CH4 e.将CH3OCH3(g)从体系中分离
(2)工业上利用CH4和H2O(g)为原料制备合成甲醇的原料CO和H2(反应Ⅰ),回答下列问题:
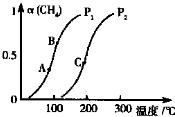
①一定条件下CH4的平衡转化率与温度、压强的关系如图,则:P1
②100℃时,1molCH4和2molH2O(g)通入体积为100L的恒容密闭容器,如果反应经10分钟达到平衡,且达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数为
③利用甲醇可以设计一种新型燃料电池:一极通入空气,一极通入CH3OH(g),电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.则在该熔融电解质中,O2-向
考点:热化学方程式,化学电源新型电池,化学平衡的影响因素
专题:
分析:(1)利用盖斯定律进行计算即可;既可增大CH4的转化率又可增大CH3OCH3产率,则使得平衡右移即可,据此选择合适答案;
(2)①依据反应特点判断压强对甲烷转化率的影响,依据温度高低判断平衡常数大小;
②利用三段式法计算化学平衡常数,利用速率公式计算氢气的反应速率即可;
③原电池中,阴离子向负极移动,阳离子向正极移动,通入甲醇的一极是负极,电极反应式为CH4O+3O2--6e-=CO2+2H2O,据此填空即可.
(2)①依据反应特点判断压强对甲烷转化率的影响,依据温度高低判断平衡常数大小;
②利用三段式法计算化学平衡常数,利用速率公式计算氢气的反应速率即可;
③原电池中,阴离子向负极移动,阳离子向正极移动,通入甲醇的一极是负极,电极反应式为CH4O+3O2--6e-=CO2+2H2O,据此填空即可.
解答:
解:(1)Ⅰ.CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+216kJ?mol-1
Ⅱ.CO(g)+2H2(g)?CH3OH(g)△H2=-90.7kJ?mol-1
Ⅲ.2CH3OH(g)?CH3OCH3(g)+H2O(g)△H3=-23.5kJ?mol-1
Ⅰ×2+Ⅱ×2+Ⅲ得:2CH4(g)+H2O(g)?CH3OCH3(g)+2H2(g),故△H=△H1×2+△H2×2+△H3=227.1kJ?mol-1,由于此反应为吸热反应,要使得CH4与H2O(g)在容积固定的反应器中进行,既可增大CH4的转化率又可增大CH3OCH3产率,即应让反应往右移,
a.升高温度,平衡右移,符合题意,正确;
b.充人Ar,不改变任何一种物质的浓度,平衡不移动,故错误;
c.使用催化剂,只加快反应速率,故错误;
d.再充人一定量CH4,平衡右移,但是甲烷转化率减小,故错误;
e.将CH3OCH3(g)从体系中分离,平衡右移,且生成甲醚增多,故正确,故选ae,
故答案为:227.1kJ?mol-1;ae;
(2)①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+216kJ?mol-1
此反应为气体体积增大的反应,增大压强,平衡左移,甲烷的转化率减小,故P1<P2,此反应为吸热反应,温度越高,则K值越大,故KA<KB<KC,
故答案为:<;KC>KB>KA;
②CH4(g)+H2O(g)?CO(g)+3H2(g)
初始浓度:0.01 0.02 0 0
变化浓度:0.005 0.005 0.005 0.015
平衡浓度:0.005 0.015 0.005 0.015
所以平衡常数K=
=2.25×10-4(mol/L)2,反应经10分钟达到平衡,即v(H2)=
=0.0015mol/(L?min),
故答案为:2.25×10-4(mol/L)2;0.0015mol/(L?min);
③原电池中,阴离子向负极移动,阳离子向正极移动,故O2-向负极移动,通入甲醇的一极是负极,电极反应式为CH4O+3O2--6e-=CO2+2H2O,
故答案为:负;CH4O+3O2--6e-=CO2+2H2O.
Ⅱ.CO(g)+2H2(g)?CH3OH(g)△H2=-90.7kJ?mol-1
Ⅲ.2CH3OH(g)?CH3OCH3(g)+H2O(g)△H3=-23.5kJ?mol-1
Ⅰ×2+Ⅱ×2+Ⅲ得:2CH4(g)+H2O(g)?CH3OCH3(g)+2H2(g),故△H=△H1×2+△H2×2+△H3=227.1kJ?mol-1,由于此反应为吸热反应,要使得CH4与H2O(g)在容积固定的反应器中进行,既可增大CH4的转化率又可增大CH3OCH3产率,即应让反应往右移,
a.升高温度,平衡右移,符合题意,正确;
b.充人Ar,不改变任何一种物质的浓度,平衡不移动,故错误;
c.使用催化剂,只加快反应速率,故错误;
d.再充人一定量CH4,平衡右移,但是甲烷转化率减小,故错误;
e.将CH3OCH3(g)从体系中分离,平衡右移,且生成甲醚增多,故正确,故选ae,
故答案为:227.1kJ?mol-1;ae;
(2)①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+216kJ?mol-1
此反应为气体体积增大的反应,增大压强,平衡左移,甲烷的转化率减小,故P1<P2,此反应为吸热反应,温度越高,则K值越大,故KA<KB<KC,
故答案为:<;KC>KB>KA;
②CH4(g)+H2O(g)?CO(g)+3H2(g)
初始浓度:0.01 0.02 0 0
变化浓度:0.005 0.005 0.005 0.015
平衡浓度:0.005 0.015 0.005 0.015
所以平衡常数K=
| 0.0153×0.005 |
| 0.005×0.015 |
| 0.015mol/L |
| 10min |
故答案为:2.25×10-4(mol/L)2;0.0015mol/(L?min);
③原电池中,阴离子向负极移动,阳离子向正极移动,故O2-向负极移动,通入甲醇的一极是负极,电极反应式为CH4O+3O2--6e-=CO2+2H2O,
故答案为:负;CH4O+3O2--6e-=CO2+2H2O.
点评:本题主要考查的是盖斯定律的应用,化学平衡的有关计算,原电池原理等,综合性较强,难度较大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
下列方程式书写正确的是( )
| A、醋酸的电离:CH3COOH+H2O?CH3COO-+H3O+ |
| B、H2SO3的电离方程式H2SO3?2H++SO32- |
| C、CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- |
| D、CaCO3的电离方程式:CaCO3?Ca2++CO32- |
常温下,pH相同的NaOH溶液和CH3COONa溶液分别加水稀释.pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )

| A、b、c两点溶液的导电能力相同 |
| B、c点溶液中c (CH3COOH)+c(OH-)=c(H+) |
| C、a、b、c三点溶液中水的电离程度a>c>b |
| D、等体积的b、c两点溶液分别与相同浓度的盐酸恰好完全反应时,消耗盐酸的体积相等 |
化学科学需要借助化学专用语言描述,下列有关化学用语不正确的是( )
A、氯化钠的电子式: |
B、Cl-的结构示意图: |
| C、乙烯的结构式:C2H4 |
D、CH4分子的比例模型: |
 对氨基苯磺酸是制取某些染料和药物的重要中间体,可由苯胺磺化得到:
对氨基苯磺酸是制取某些染料和药物的重要中间体,可由苯胺磺化得到:


 (有若碱性,易被氧化)
(有若碱性,易被氧化) 、
、 等
等 有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图
有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图 .
.
