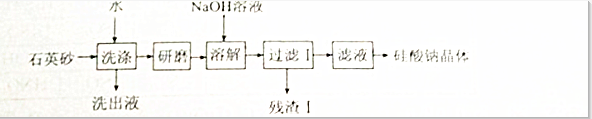
题目内容
石油脱硫废气中含有较多的硫化氢,如何对其进行综合利用回收硫是研究的热点.完成下列填空:
(1)实验室用启普发生器制备硫化氢气体,原料可选用 (选填编号).
a.稀盐酸与硫化铜b.稀硫酸与硫化亚铁
c.稀硝酸与硫化锌d.浓盐酸与硫化钠
若要得到一瓶干燥纯净的硫化氢,除启普发生器外,还应选用的装置依次是 (填编号).
(2)如图⑧,将充满相同体积(同温同压)的二氧化硫与硫化氢气体的集气瓶对口放置,抽去毛玻璃片充分反应.观察到的现象是 .检验最终剩余气体的方法是 .
(3)一种回收硫的方法称为克劳斯法,其主要流程是先将部分H2S氧化为SO2,再与剩余H2S作用.若废气中含67.2m3 H2S,为充分回收硫,需要消耗空气 m3(设空气中O2的体积分数为0.20).
(4)工业上常用吸收-电解法回收硫.主要过程分两步:
第一步,用FeCl3溶液吸收H2S.此过程中溶液pH (填“增大”、“减小”或“不变”).
第二步,过滤后对滤液进行电解,发生反应的离子方程式为:2Fe2++2H+
2Fe3++H2↑
吸收-电解法的优势是:①H2S的吸收率高;② .
有人提出,第二步可以改为向所得溶液中通入O2,也能实现同样的目的,此时发生反应的化学方程式为 .
(5)请再设计一种从硫化氢中回收硫的方法(用化学方程式表示). .
(1)实验室用启普发生器制备硫化氢气体,原料可选用
a.稀盐酸与硫化铜b.稀硫酸与硫化亚铁
c.稀硝酸与硫化锌d.浓盐酸与硫化钠
若要得到一瓶干燥纯净的硫化氢,除启普发生器外,还应选用的装置依次是

(2)如图⑧,将充满相同体积(同温同压)的二氧化硫与硫化氢气体的集气瓶对口放置,抽去毛玻璃片充分反应.观察到的现象是
(3)一种回收硫的方法称为克劳斯法,其主要流程是先将部分H2S氧化为SO2,再与剩余H2S作用.若废气中含67.2m3 H2S,为充分回收硫,需要消耗空气
(4)工业上常用吸收-电解法回收硫.主要过程分两步:
第一步,用FeCl3溶液吸收H2S.此过程中溶液pH
第二步,过滤后对滤液进行电解,发生反应的离子方程式为:2Fe2++2H+
| 通电 |
吸收-电解法的优势是:①H2S的吸收率高;②
有人提出,第二步可以改为向所得溶液中通入O2,也能实现同样的目的,此时发生反应的化学方程式为
(5)请再设计一种从硫化氢中回收硫的方法(用化学方程式表示).
考点:常见气体制备原理及装置选择,物质分离、提纯的实验方案设计
专题:
分析:(1)启普发生器制取气体,所选试剂应为块状固体和液体,且反应不需要加热,气体不溶于水;依据硫化氢的性质回答即可;
(2)二氧化硫的密度大,抽去毛玻璃片之后,二氧化硫与硫化氢混合,二氧化硫具有强化性,硫化氢具有还原性,两者反应生成硫单质,据此解答即可;
(3)依据原理书写化学反应方程式,依据方程式找出硫化氢与氧气的关系,最后利用氧气所占空气的体积分数计算即可;
(4)依据化学反应方程式判断溶液酸性强弱变化,依据化学反应方程式得出铁离子可以被循环利用,最后利用氧化还原反应原理书写方程式即可;
(5)硫化氢具有还原性,利用氧化性物质与其反应即可得到单质S,据此解答即可.
(2)二氧化硫的密度大,抽去毛玻璃片之后,二氧化硫与硫化氢混合,二氧化硫具有强化性,硫化氢具有还原性,两者反应生成硫单质,据此解答即可;
(3)依据原理书写化学反应方程式,依据方程式找出硫化氢与氧气的关系,最后利用氧气所占空气的体积分数计算即可;
(4)依据化学反应方程式判断溶液酸性强弱变化,依据化学反应方程式得出铁离子可以被循环利用,最后利用氧化还原反应原理书写方程式即可;
(5)硫化氢具有还原性,利用氧化性物质与其反应即可得到单质S,据此解答即可.
解答:
解:(1)a.硫化铜不溶于盐酸,故a错误;
b.稀硫酸与硫化亚铁为块状固体和液体反应,且不需要加热,故b正确;
c.稀硝酸具有强氧化性,故c错误;
d.若用启普发生器制取气体,所选试剂应为块状固体和液体,且反应不需要加热,故d错误;
稀硫酸与硫化亚铁,稀盐酸与硫化亚铁制备硫化氢气体,反应试剂是固体和液体不加热反应生成气体,气体需要干燥,干燥硫化氢气态用氯化钙(②),硫化氢密度大于空气,故利用向上排空气法收集,即利用⑤,尾气需要处理,氢氧化钠与硫化氢反应,即选择⑥,
故答案为:b;②⑤⑥;
(2)二氧化硫的密度大,抽去毛玻璃片之后,二氧化硫与硫化氢混合,二氧化硫具有强化性,硫化氢具有还原性,两者反应生成硫单质和水,化学反应方程式为:2H2S+SO2=2H2O+3S↓,故反应现象为:有黄色粉末析出,瓶壁上有小液滴,由于两者是按照体积比相等混合,依据化学反应方程式得出:二氧化硫有剩余,二氧化硫可使湿润的品红试纸褪色,利用此现象检验二氧化硫的存在即可,
故答案为:有黄色粉末析出,瓶壁上有小液滴;将湿润的品红试纸伸入瓶中,试纸褪色;
(3)依据题意可知:克劳斯法回收S涉及反应分别为:2H2S+3O2=2H2O+2SO2①;2H2S+SO2=2H2O+3S↓②,①+②×2,得即每有6molH2S转化生成S,需要氧气3mol,若废气中含67.2m3 H2S,那么消耗氧气的体积为:
m3,即消耗空气为:
m3×5=168m3,故答案为:168;
(4)H2S具有强还原性,Fe3+具有较强的氧化性,可以将S2-氧化成S单质,本身被还原成Fe2+,离子反应方程式为:2Fe3++H2S═S↓+2Fe2++2H+,由于硫化氢为弱酸,盐酸为强酸,故反应后,氢离子浓度变大,故pH减小,过滤后对滤液进行电解,发生反应的离子方程式为:2Fe2++2H+
2Fe3++H2↑,分析发现又生成氯化铁,故氯化铁得到了循环利用,由于氧气具有强氧化性,产物是水,故可以利用氧气氧化亚铁离子变成铁离子,化学反应方程式为:4FeCl2+O2+4HCl=4FeCl3+2H2O,
故答案为:减小;FeCl3溶液可循环利用;4FeCl2+O2+4HCl=4FeCl3+2H2O;
(5)硫化氢具有还原性,可以与氯气、氧气等反应,在此以氧气为例,化学反应方程式为2H2S+O2=2S+2H2O,故答案为:2H2S+O2=2S↓+2H2O.
b.稀硫酸与硫化亚铁为块状固体和液体反应,且不需要加热,故b正确;
c.稀硝酸具有强氧化性,故c错误;
d.若用启普发生器制取气体,所选试剂应为块状固体和液体,且反应不需要加热,故d错误;
稀硫酸与硫化亚铁,稀盐酸与硫化亚铁制备硫化氢气体,反应试剂是固体和液体不加热反应生成气体,气体需要干燥,干燥硫化氢气态用氯化钙(②),硫化氢密度大于空气,故利用向上排空气法收集,即利用⑤,尾气需要处理,氢氧化钠与硫化氢反应,即选择⑥,
故答案为:b;②⑤⑥;
(2)二氧化硫的密度大,抽去毛玻璃片之后,二氧化硫与硫化氢混合,二氧化硫具有强化性,硫化氢具有还原性,两者反应生成硫单质和水,化学反应方程式为:2H2S+SO2=2H2O+3S↓,故反应现象为:有黄色粉末析出,瓶壁上有小液滴,由于两者是按照体积比相等混合,依据化学反应方程式得出:二氧化硫有剩余,二氧化硫可使湿润的品红试纸褪色,利用此现象检验二氧化硫的存在即可,
故答案为:有黄色粉末析出,瓶壁上有小液滴;将湿润的品红试纸伸入瓶中,试纸褪色;
(3)依据题意可知:克劳斯法回收S涉及反应分别为:2H2S+3O2=2H2O+2SO2①;2H2S+SO2=2H2O+3S↓②,①+②×2,得即每有6molH2S转化生成S,需要氧气3mol,若废气中含67.2m3 H2S,那么消耗氧气的体积为:
| 67.2 |
| 2 |
| 67.2 |
| 2 |
(4)H2S具有强还原性,Fe3+具有较强的氧化性,可以将S2-氧化成S单质,本身被还原成Fe2+,离子反应方程式为:2Fe3++H2S═S↓+2Fe2++2H+,由于硫化氢为弱酸,盐酸为强酸,故反应后,氢离子浓度变大,故pH减小,过滤后对滤液进行电解,发生反应的离子方程式为:2Fe2++2H+
| 通电 |
故答案为:减小;FeCl3溶液可循环利用;4FeCl2+O2+4HCl=4FeCl3+2H2O;
(5)硫化氢具有还原性,可以与氯气、氧气等反应,在此以氧气为例,化学反应方程式为2H2S+O2=2S+2H2O,故答案为:2H2S+O2=2S↓+2H2O.
点评:本题以脱硫为载体考查了可逆反应、氧化还原反应、电解原理等知识点,本题是一道综合题,难度中等,考查了学生运用知识解决问题的能力,涉及到的知识点较多.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
A、12C和14C的原子结构示意图均为 |
| B、在Na2O2和CaCl2中均含有共价键和离子键 |
C、结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
D、电子式 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
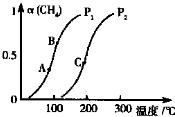 天然气在工农业生产中具有重要意义.
天然气在工农业生产中具有重要意义.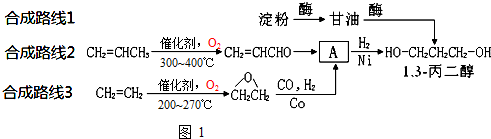
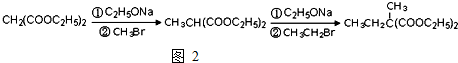
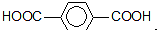 为原料可以合成聚酯PTT,写出其化学方程式
为原料可以合成聚酯PTT,写出其化学方程式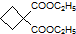 ,再转化为
,再转化为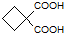 .
.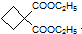 ,必须先合成哪些物质?(用合成该物质的化学方程式回答)
,必须先合成哪些物质?(用合成该物质的化学方程式回答)

 .
.