题目内容
 对氨基苯磺酸是制取某些染料和药物的重要中间体,可由苯胺磺化得到:
对氨基苯磺酸是制取某些染料和药物的重要中间体,可由苯胺磺化得到:
实验室可用苯胺、浓硫酸为原料,利用如图所示实验装置合成.
实验步骤如下:
①取一个250mL的仪器a,加入10mL苯胺及几粒沸石,放入冷水中冷却,小心地加入18mL浓硫酸.再分别装上冷凝管、温度计等.
②将a置于油浴中缓慢加热至l70~180℃,维持此温度约2.5h.
③将反应产物冷却至约50℃后,倒入盛有l00mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出.用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品.
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集产品,晾干.(提示:100mL水在20℃时可溶解对氨基苯磺酸1.089,在100℃时可溶解6.67g)
(1)仪器a的名称是
(2)步骤②中采用油浴加热,下列说法正确的是
A.便于控制温度 B.也可以改用水浴加热 C.温度计的水银球也可浸在油中
(3)步骤③用冷水洗涤的优点是
(4)步骤③和④均进行了抽滤操作,在抽滤完毕停止抽滤时,应注意先
(5)步骤④有时需重复进行多次,其目的是
考点:有机物的合成
专题:实验题
分析:(1)仪器a为三颈烧瓶,液体加热需要防止暴沸;
(2)水浴加热的温度受水的沸点限制,最高加热温度为100℃,油浴加热可以弥补这一不足,油浴加热比较均匀,温度计的位置应在在反应体系中;
(3)因产品在热水中的溶解度大,用冷水洗涤可以减少损失;
(4)抽滤完毕停止抽滤时,为防止倒吸,先拆下橡皮管,再关水龙头;
(5)得到产品若有部分杂质时,可以用多次溶解洗涤抽滤的方法,可以提高产物的纯度,注意由于多次进行,会有部分产品损失,需要将母液回收利用以提高产率.
(2)水浴加热的温度受水的沸点限制,最高加热温度为100℃,油浴加热可以弥补这一不足,油浴加热比较均匀,温度计的位置应在在反应体系中;
(3)因产品在热水中的溶解度大,用冷水洗涤可以减少损失;
(4)抽滤完毕停止抽滤时,为防止倒吸,先拆下橡皮管,再关水龙头;
(5)得到产品若有部分杂质时,可以用多次溶解洗涤抽滤的方法,可以提高产物的纯度,注意由于多次进行,会有部分产品损失,需要将母液回收利用以提高产率.
解答:
解:(1)仪器a为三颈烧瓶,液体加热时,为防止暴沸,通常需要加入碎瓷片,故答案为:三颈烧瓶;防止暴沸;
(2)A.油浴加热比较均匀,便于控制温度,故A正确;
B.水浴加热的温度受水的沸点限制,最高加热温度为100℃,而该反应需要加热至l70~180℃,故不能利用水溶加热,故B错误;
C.实验控制液体的温度,温度计的位置需要在反应体系中,故C正确,
故选:AC;
(3)因产品在热水中的溶解度大,用冷水洗涤可以减少损失,故答案为:可减少产品的损失;
(4)抽滤完毕停止抽滤时,为防止倒吸,先拆下橡皮管,再关水龙头,故答案为:拆下连接泵和吸滤瓶的橡皮管;关闭水龙头;
(5)得到产品若有部分杂质时,可以用多次溶解洗涤抽滤的方法,可以提高产物的纯度,故答案为:提高产品的纯度.
(2)A.油浴加热比较均匀,便于控制温度,故A正确;
B.水浴加热的温度受水的沸点限制,最高加热温度为100℃,而该反应需要加热至l70~180℃,故不能利用水溶加热,故B错误;
C.实验控制液体的温度,温度计的位置需要在反应体系中,故C正确,
故选:AC;
(3)因产品在热水中的溶解度大,用冷水洗涤可以减少损失,故答案为:可减少产品的损失;
(4)抽滤完毕停止抽滤时,为防止倒吸,先拆下橡皮管,再关水龙头,故答案为:拆下连接泵和吸滤瓶的橡皮管;关闭水龙头;
(5)得到产品若有部分杂质时,可以用多次溶解洗涤抽滤的方法,可以提高产物的纯度,故答案为:提高产品的纯度.
点评:本题考查有机物的合成及实验,充分利用实验中的信息,注意实验基本操作,注重对有机化学实验的考查,题目难度中等.

练习册系列答案
相关题目
下列物质中不属于烃的是( )
| A、CH4 |
| B、C6H6 |
| C、C2H5Cl |
| D、C2H4 |
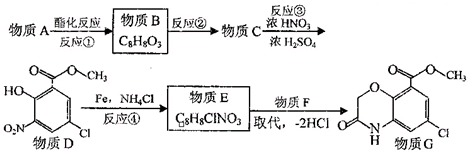
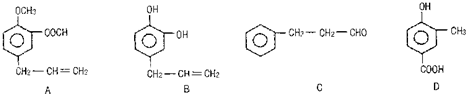
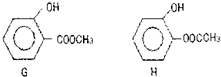
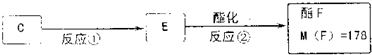
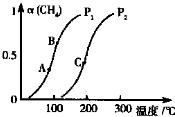 天然气在工农业生产中具有重要意义.
天然气在工农业生产中具有重要意义.

 .
.

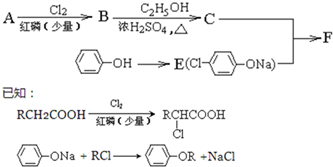
 .合成过程中无机试剂任选;合成路线流程图示例为:CH3CH2OH
.合成过程中无机试剂任选;合成路线流程图示例为:CH3CH2OH