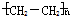题目内容
11.用溴水除去甲烷气体中的少量乙烯,其原理为乙烯能与溴发生( )| A. | 取代反应 | B. | 加成反应 | C. | 水解反应 | D. | 聚合反应 |
分析 乙烯含碳碳双键,与溴水发生加成反应,而甲烷不能,以此来解答.
解答 解:乙烯含碳碳双键,与溴水发生加成反应,而甲烷不能,则用溴水、洗气可除去甲烷气体中的少量乙烯,其原理为乙烯能与溴发生加成反应,
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的性质、性质差异及发生的反应等为解答的关键,侧重分析与应用能力的考查,注意有机反应的应用,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
1.下面为钠及其化合物相关的实验报告,请根据题意完成各空白处:
实 验 报 告
(一)实验目的:探究钠及其化合物的有关性质
(二)实验药品及仪器:金属钠,蒸馏水,酒精灯,试管,木条,石棉网,铁架台
(三)实验过程:
(四)实验反思:
(1)钠的化学性质活泼,在自然界中全部以化合态形态(填“游离态”或“化合态”)存在,因此少量钠应保存在煤油中.
(2)写出Na2O2的一种用途:作供氧剂或利用强氧化性杀菌消毒.
实 验 报 告
(一)实验目的:探究钠及其化合物的有关性质
(二)实验药品及仪器:金属钠,蒸馏水,酒精灯,试管,木条,石棉网,铁架台
(三)实验过程:
| 实验步骤 | 实验现象 | 化学方程式或结论 |
| 金属Na长时间放置在空气中 | 银白色的金属光泽消失,迅速变暗,有水珠生成,最终生成白色的粉末 | ①4Na+O2═2Na2O Na2O+H2O═2NaOH 2Na+2H2O═2NaOH+H2↑ 2NaOH+CO2═Na2CO3+H2O |
| 将一块Na置于石棉网上,点燃酒精灯加热 | 钠先熔成小球,剧烈燃烧并发出黄色的火焰,生成②淡黄色色的粉末 | 2Na+O2 ═Na2O2 |
| 往上述生成的 Na2O2上滴加蒸馏水 | 生成的气体能使带火星的木条复燃 | 该气体为③O2 |
(1)钠的化学性质活泼,在自然界中全部以化合态形态(填“游离态”或“化合态”)存在,因此少量钠应保存在煤油中.
(2)写出Na2O2的一种用途:作供氧剂或利用强氧化性杀菌消毒.
2.下列物质的性质递变规律正确的是( )
| A. | O、S、Na的原子半径依次增大 | B. | LiOH、KOH、CsOH的碱性依次减弱 | ||
| C. | H2CO3的酸性比H3BO3的酸性弱 | D. | Cl-、Br-、I-的还原性依次减弱 |
19.在光照条件下,将等物质的量的甲烷和氯气混合充分反应后,得到产物的物质的量最大的是( )
| A. | CH3Cl | B. | CHCl3 | C. | CCl4 | D. | HCl |
6.在萃取-分液实验中,振荡分液漏斗的操作正确的是( )
| A. |  | B. | 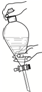 | C. |  | D. | 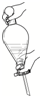 |
16.下列鉴别方法正确的是( )
| A. | 用澄清石灰水鉴别CO2和SO2 | |
| B. | 用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 用CO2鉴别NaAlO2溶液和NaClO溶液 | |
| D. | 用Ba(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液 |
3.元素性质呈周期性变化的根本原因是( )
| A. | 最外层电子数呈周期性变化 | B. | 元素的相对原子质量逐渐增大 | ||
| C. | 核电荷数逐渐增大 | D. | 核外电子排布呈周期性变化 |
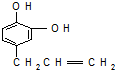

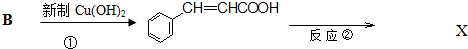
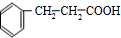 .反应①的化学方程式为:
.反应①的化学方程式为: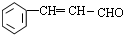 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$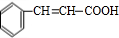 +Cu2O+2H2O.
+Cu2O+2H2O.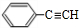 $→_{催化剂}^{HCl}$
$→_{催化剂}^{HCl}$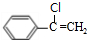 $→_{一定条件}^{CO、H_{2}}$
$→_{一定条件}^{CO、H_{2}}$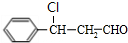 $→_{△}^{NaOH/醇}$
$→_{△}^{NaOH/醇}$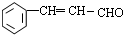 .
.