题目内容
6.在萃取-分液实验中,振荡分液漏斗的操作正确的是( )| A. |  | B. |  | C. |  | D. |  |
分析 在萃取-分液实验中,振荡分液漏斗的操作:左手手心顶住分液漏斗的塞子,并用右手握住漏斗颈部,防止塞子松动,倒转一起上下振荡,据此解答.
解答 解:A.振荡分液漏斗的操作:左手手心顶住分液漏斗的塞子,并用右手握住漏斗颈部,防止塞子松动,倒转一起上下振荡,故A正确;
B.左手手心顶住分液漏斗的塞子,防止活塞脱落,故B错误;
C.左手手心顶住分液漏斗的塞子,并用右手握住漏斗颈部,防止塞子松动,故C错误;
D.应将分液漏斗倒转过来上下振荡,故D错误;
故选:A.
点评 本题考查了实验的基本操作,明确萃取分液实验中振荡分液漏斗的正确操作过程是解题关键,题目难度不大.

练习册系列答案
相关题目
5.某烃的一种同分异构体,一氯代产物只有一种,则该烃的分子式可能为( )
| A. | C6H14 | B. | C7H16 | C. | C8H18 | D. | C9H20 |
1.X、Y、Z、R、M是元素周期表中原子序数依次增大的五种短周期元素,其相关信息如下表:
(1)Y、Z、R的第一电离能从大到小的顺序是N>O>C(填元素符号)
(2)Z、R的最简单氢化物中稳定性强的是H2O,沸点高的是H2O(填化学式)
(3)甲是由上述3种元素组成的常见化合物,常温下pH=3的甲溶液中由水电离c(H+)=10-3mol/L,则甲的化学式是NH4NO3.
(4)直线型分子Y2Z2中所有原子都达到8电子稳定结构,则分子中σ键与π键的个数之比是3:4.
(5)常温下0.58gY4H10完全燃烧放出29kJ的热量,请写出Y4H10燃烧热的热化学方程式C4H10(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(l)△H=-2900kJ/mol.
| 元素 | 相关信息 |
| X | X的一种核素的原子核中没有中子 |
| Y | Y原子的核外电子占据4个原子轨道 |
| Z | Z的气态氢化物能使湿润的红色石蕊试纸变蓝 |
| R | R是地壳中含量最高的元素 |
| M | M的单质与冷水剧烈反应,生成的强碱中含有电子数相同的阴阳离子 |
(2)Z、R的最简单氢化物中稳定性强的是H2O,沸点高的是H2O(填化学式)
(3)甲是由上述3种元素组成的常见化合物,常温下pH=3的甲溶液中由水电离c(H+)=10-3mol/L,则甲的化学式是NH4NO3.
(4)直线型分子Y2Z2中所有原子都达到8电子稳定结构,则分子中σ键与π键的个数之比是3:4.
(5)常温下0.58gY4H10完全燃烧放出29kJ的热量,请写出Y4H10燃烧热的热化学方程式C4H10(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(l)△H=-2900kJ/mol.
11.用溴水除去甲烷气体中的少量乙烯,其原理为乙烯能与溴发生( )
| A. | 取代反应 | B. | 加成反应 | C. | 水解反应 | D. | 聚合反应 |
16.下列离子方程式正确的是( )
| A. | 盐酸与氢氧化铜反应:H++OHˉ═H2O | |
| B. | 碳酸钡溶于醋酸:BaCO3+2H+═Ba2++H2O+CO2↑ | |
| C. | 澄清石灰中通入过量二氧化碳:Ca2++2OHˉ+CO2═CaCO3↓+H2O | |
| D. | 金属钠跟水反应:2Na+2H2O═2Na++2OHˉ+H2↑ |
 KMnO4是锰的重要化合物,它是一种良好的氧化剂,用来漂白毛、棉和丝,或使油类脱色.其制备方法如下:
KMnO4是锰的重要化合物,它是一种良好的氧化剂,用来漂白毛、棉和丝,或使油类脱色.其制备方法如下: 2KMnO4+2KOH+H2↑.在整个制备流程中可循环利用的物质是氢氧化钾(写名称).
2KMnO4+2KOH+H2↑.在整个制备流程中可循环利用的物质是氢氧化钾(写名称).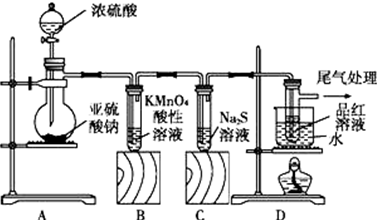
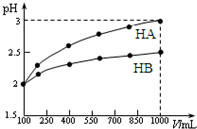 已知100mL pH=2的两种一元酸HA和HB,稀释过程中pH与溶液体积的关系如图所示.
已知100mL pH=2的两种一元酸HA和HB,稀释过程中pH与溶液体积的关系如图所示.