题目内容
20.A、B的结构简式如下所示:A.

B.

已知 CH2=CH2+H2+CO$\stackrel{一定条件}{→}$CH3CH2CHO
请回答下列问题:
(1)1mol化合物A和足量浓溴水反应,参加反应的单质溴4mol.
(2)

已知X是A的同分异构体,X的结构简式是
 .反应①的化学方程式为:
.反应①的化学方程式为: +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O+2H2O.
+Cu2O+2H2O.(3)A 有多种同分同分异构体,能满足以下条件的A 的同分同分异构体有6种.
①苯环上有两个取代基 ②能使FeCl3溶液显紫色 ③能发生银镜反应
(4)写出以苯乙炔为主要原料制取化合物B合成流程图:
 $→_{催化剂}^{HCl}$
$→_{催化剂}^{HCl}$ $→_{一定条件}^{CO、H_{2}}$
$→_{一定条件}^{CO、H_{2}}$ $→_{△}^{NaOH/醇}$
$→_{△}^{NaOH/醇}$ .
.例:由乙醇合成聚乙烯的反应流程图可表示为
CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$→_{催化剂}^{高温、高压}$

分析 (1)碳碳双键与溴水发生加成反应,酚羟基的邻位、对位位置可以与溴发生取代反应;
(2)X是A的同分异构体,则 中碳碳双键与氢气发生加成反应生成X,X的结构简式是
中碳碳双键与氢气发生加成反应生成X,X的结构简式是 ,B为
,B为 .
.
(3)满足以下条件的A 的同分同分异构体:①苯环上有两个取代基,②能使FeCl3溶液显紫色,说明含有酚羟基,③能发生银镜反应,说明含有醛基,其中一个取代基为-OH,另外的取代基为-CH2CH2CHO,或者-CH(CH3)CHO,各有邻、间、对3种;
(4)苯乙炔与HCl发生加成反应生成 ,然后与CO、氢气在一定条件下得到
,然后与CO、氢气在一定条件下得到 ,最后在氢氧化钠醇溶液、加热条件下发生消去反应得到
,最后在氢氧化钠醇溶液、加热条件下发生消去反应得到 .
.
解答 解:(1)碳碳双键与溴水发生加成反应,酚羟基的邻位、对位位置可以与溴发生取代反应,1mol化合物A和足量浓溴水反应,参加反应的单质溴4mol,
故答案为:4;
(2)X是A的同分异构体,则 中碳碳双键与氢气发生加成反应生成X,X的结构简式是
中碳碳双键与氢气发生加成反应生成X,X的结构简式是 ,B为
,B为 ,反应①的化学方程式为:
,反应①的化学方程式为: +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O+2H2O,
+Cu2O+2H2O,
故答案为: ;
; +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O+2H2O;
+Cu2O+2H2O;
(3)满足以下条件的A 的同分同分异构体:①苯环上有两个取代基,②能使FeCl3溶液显紫色,说明含有酚羟基,③能发生银镜反应,说明含有醛基,其中一个取代基为-OH,另外的取代基为-CH2CH2CHO,或者-CH(CH3)CHO,各有邻、间、对3种,共有6种,
故答案为:6;
(4)苯乙炔与HCl发生加成反应生成 ,然后与CO、氢气在一定条件下得到
,然后与CO、氢气在一定条件下得到 ,最后在氢氧化钠醇溶液、加热条件下发生消去反应得到
,最后在氢氧化钠醇溶液、加热条件下发生消去反应得到 ,合成路线流程图为:
,合成路线流程图为: $→_{催化剂}^{HCl}$
$→_{催化剂}^{HCl}$ $→_{一定条件}^{CO、H_{2}}$
$→_{一定条件}^{CO、H_{2}}$ $→_{△}^{NaOH/醇}$
$→_{△}^{NaOH/醇}$ ,
,
故答案为: $→_{催化剂}^{HCl}$
$→_{催化剂}^{HCl}$ $→_{一定条件}^{CO、H_{2}}$
$→_{一定条件}^{CO、H_{2}}$ $→_{△}^{NaOH/醇}$
$→_{△}^{NaOH/醇}$ .
.
点评 本题考查有机物的推断与合成、限制条件同分异构体书写、有机物的结构与性质等,是对有机化学基础的综合考查,较好地考查学生对知识的迁移运用能力.

| A. | 硝酸银与氯化钾溶液的反应:Ag++Cl-═AgCl↓ | |
| B. | 硝酸与氢氧化钠溶液的反应:H++OH-═H2O | |
| C. | 碳酸钙与盐酸的反应:CO32-+2H+═CO2↑+H2O | |
| D. | 锌粒与稀硫酸的反应:Zn+2H+═Zn2++H2↑ |
| A. | 取代反应 | B. | 加成反应 | C. | 水解反应 | D. | 聚合反应 |
| A. | 向AgI悬浊液中滴加少量NaCl溶液,沉淀转化为白色 | |
| B. | 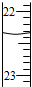 滴定达终点时,如图滴定管的正确读数为23.65 mL | |
| C. | 25℃时,在Mg(OH)2悬浊液中加入少量NH4Cl固体后,c(Mg2+)增大 | |
| D. | 测定溶液的pH时,应先将pH试纸润湿,然后进行检测 |
(1)上述实验中发生反应的离子方程式有:Zn+2H+═Zn2++H2↑、Zn+Cu2+═Zn2++Cu;
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn-稀硫酸原电池,加快了氢气产生的速率;
(3)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度;适当增加硫酸的浓度、增加锌粒的表面积等(答两种);
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②反应一段时间后,实验A中的金属呈灰黑色,实验E中的金属呈暗红色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的CuSO4后,生成的Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积,使得生成氢气的速率下降.
④实验A测得:收集到产生H2体积为112mL(标准状况下)时所需的时间为10分钟,求化学反应速率ν(H2SO4)=0.01mol/(L•min)(忽略反应前后溶液体积变化).
| A. | 硅太阳能电池、计算机芯片、光导纤维都用到硅单质 | |
| B. | 水晶镜片、石英钟表、玛瑙手镯含有SiO2 | |
| C. | 水泥路桥、门窗玻璃、砖瓦、陶瓷餐具所用材料为硅酸盐 | |
| D. | 熔融烧碱时不能使用普通玻璃坩埚、石英坩埚和陶瓷坩埚 |
| A. | 利用氢氧化铁胶体的“丁达尔效应”,可以除去水中的悬浮颗粒,从而达到净水的效果 | |
| B. | 从分类的角度看,混合物、分散系、胶体的从属关系如图所示: | |
| C. | 通过观察外观的方法,即可将溶液、胶体和浊液区分开来 | |
| D. | 胶体中分散质粒子的运动是无规律的,溶液中分散质粒子的运动是有规律的 |
| A. | 发生装置与用KClO3制取O2的装置相同 | |
| B. | 可用排水法收集氨气 | |
| C. | 氨气的验满可以用蘸有浓盐酸的玻璃棒放于试管口附近 | |
| D. | 可以用碱石灰干燥氨气 |
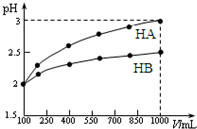 已知100mL pH=2的两种一元酸HA和HB,稀释过程中pH与溶液体积的关系如图所示.
已知100mL pH=2的两种一元酸HA和HB,稀释过程中pH与溶液体积的关系如图所示.