题目内容
11.原子的最外电子层中有8个电子(最外层为1层时,最多有2个电子)的结构是相对稳定的结构.分析 原子最外层电子为8个时达到相对稳定结构,当最外层只有1层时,最多2个电子就达到相对稳定结构.
解答 解:原子通过得失电子或者共用电子对使最外层达到8个电子时,结构就相对稳定,当最外层只有1层时,最多2个电子就达到相对稳定结构,
故答案为:8;1;2.
点评 本题考查原子核外电子排布,原子达到相对稳定结构的条件是比较基础的知识,注意结构与性质的关系.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
1.乙酸与乙醇的酯化反应中,乙醇的结构简式为 C2H518OH,则反应一段时间后,18O原子存在于( )
| A. | 存在于乙酸的分子中 | B. | 存在于乙醇的分子中 | ||
| C. | 存在于乙酸和乙酸乙酯分子中 | D. | 存在于乙醇和乙酸乙酯分子中 |
2.下列叙述正确的是( )
| A. | 1.00molNaCl中含有6.02×1023个NaCl分子 | |
| B. | 从100mL,1 mol/L的NaCl溶液中取出10 mL,其物质的量浓度是0.1 mol/L | |
| C. | 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 | |
| D. | 欲配制1.00L,1.00mol•L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 |
19.下列有关仪器使用方法或实验操作正确的是( )
| A. | 洗净的锥形瓶和容量瓶可以放进烘箱中烘干 | |
| B. | 酸式滴定管装标准溶液前,必须先用该溶液润洗 | |
| C. | 酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差 | |
| D. | 所有玻璃仪器加热时均需垫石棉网 |
6.肼(N2H4)又称联氨,可用如下方法制备:CO(NH2)2+ClO-+OH-=N2H4+Cl-+CO32-+H2O,下列说法不正确的是( )
| A. | N2H4是氧化产物 | B. | N2H4中存在极性键和非极性键 | ||
| C. | 配平后,OH-的化学计量数为2 | D. | 生成3.2gN2H4转移0.lmol电子 |
16.古诗词是古人留给我们的宝贵财富,下列诗句中不涉及氧化还原反应的是( )
| A. | 春蚕到死丝方尽,蜡炬成灰泪始干 | B. | 粉身碎骨浑不怕,要留清白在人间 | ||
| C. | 爆竹声中一岁除,春风送暖入屠苏 | D. | 野火烧不尽,春风吹又生 |
3.下列反应中,属于取代反应的是( )
| A. | 在催化剂存在条件下乙烯与溴反应制 1,2-二溴乙烷 | |
| B. | 在一定条件下苯与氢气反应制取环己烷 | |
| C. | 甲苯使酸性高锰酸钾溶液褪色 | |
| D. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯 |
20.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4L H2O中含有的分子数为NA | |
| B. | 28g N2中含有的分子数为NA | |
| C. | 1mol Mg与足量稀盐酸反应转移的电子数为NA | |
| D. | 1L 1mol•L-1 Na2 CO3溶液中含有的钠离子数为NA |
1.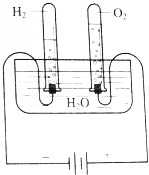 (1)根据图所示的电解水原理进行实验,观察不同时间试管内的气体体积的变化.生成的O2和H2体积的比各约为多少?
(1)根据图所示的电解水原理进行实验,观察不同时间试管内的气体体积的变化.生成的O2和H2体积的比各约为多少?
(2)假设电解了1.8g H2O,根据电解水的化学方程式计算生成O2、H2的质量,根据O2、H2的摩尔质量,计算物质的量,并通过下表进行比较.
根据该实验的观察与推算能否初步得出下列结论:在相同温度和压强下.1molO2和H2的体积相同.
 (1)根据图所示的电解水原理进行实验,观察不同时间试管内的气体体积的变化.生成的O2和H2体积的比各约为多少?
(1)根据图所示的电解水原理进行实验,观察不同时间试管内的气体体积的变化.生成的O2和H2体积的比各约为多少?(2)假设电解了1.8g H2O,根据电解水的化学方程式计算生成O2、H2的质量,根据O2、H2的摩尔质量,计算物质的量,并通过下表进行比较.
| 质量g | 物质的量 | H2 和O2物质的量的比 | |
| H2 | |||
| O2 |