题目内容
6.48克碳在3.5mol氧气中不完全燃烧,待反应物耗尽,且C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol
与这些碳完全燃烧相比,损失的热量是( )
| A. | 1132 kJ | B. | 283kJ | C. | 442 kJ | D. | 990.5kJ |
分析 根据n=$\frac{m}{M}$计算出48g碳的物质的量,然后列式计算出反应生成二氧化碳、CO的物质的量;与这些碳完全燃烧相比,损失的热量是由于CO没有转化成二氧化碳,让1molCO完全燃烧放出的热量即为损失的热量,结合碳的燃烧热计算出损失的热量即可.
解答 解:48g碳的物质的量为:$\frac{48g}{12g/mol}$=4mol,4mol碳完全燃烧消耗4mol氧气,说明氧气不足,反应生成CO和二氧化碳的混合物,
设反应生成CO2、CO的物质的量分别为x、y,
则:$\left\{\begin{array}{l}{x+y=4}\\{x+\frac{1}{2}y=3.5}\end{array}\right.$,
解得:$\left\{\begin{array}{l}{x=3mol}\\{y=1mol}\end{array}\right.$
与这些碳完全燃烧相比,损失的热量是由于CO没有转化成二氧化碳,让1molCO完全燃烧放出的热量即为损失的热量,
1molCO完全燃烧生成二氧化碳气体放出的热量为:283kJ/mol×1mol=283kJ,
故选B.
点评 本题考查了反应热的计算,题目难度中等,明确损失热量的实质为解答关键,注意掌握热化学方程式表示的意义,试题侧重考查学生的分析能力就化学计算能力.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
17.取两支试管A、B,分别加入5mL 4%、5mL 12%的过氧化氢溶液,再各加入几滴0.2mol/L的氯化铁溶液.下列说法或操作正确的是( )
| A. | 、加入氯化铁的目的是加深溶液颜色,放大实验现象 | |
| B. | 、本实验的目的是研究浓度对双氧水分解速率的影响 | |
| C. | 、本实验过程中A、B试管都不明显,可以将那个很不明显的试管放入热水浴中来观察 | |
| D. | 、小明刚把A药品准备好,就有事情出去了,第二天继续这个实验来进行比较 |
1.乙酸与乙醇的酯化反应中,乙醇的结构简式为 C2H518OH,则反应一段时间后,18O原子存在于( )
| A. | 存在于乙酸的分子中 | B. | 存在于乙醇的分子中 | ||
| C. | 存在于乙酸和乙酸乙酯分子中 | D. | 存在于乙醇和乙酸乙酯分子中 |
18.下列有关说法正确的是( )
| A. | 将pH=10的浓氨水稀释,溶液中所有离子的浓度都减小 | |
| B. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 | |
| D. | pH=3的盐酸和pH=11的氨水等体积混合液中,c(H+)<c(OH-) |
16.古诗词是古人留给我们的宝贵财富,下列诗句中不涉及氧化还原反应的是( )
| A. | 春蚕到死丝方尽,蜡炬成灰泪始干 | B. | 粉身碎骨浑不怕,要留清白在人间 | ||
| C. | 爆竹声中一岁除,春风送暖入屠苏 | D. | 野火烧不尽,春风吹又生 |
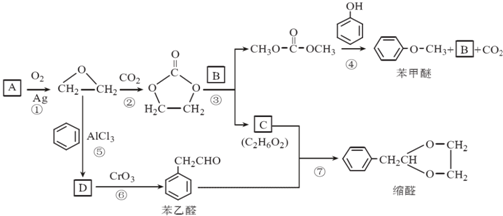
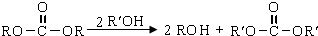
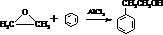 .
.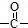 结构的苯乙醛的所有同分异构体的结构简式:
结构的苯乙醛的所有同分异构体的结构简式: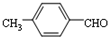 、
、 .
.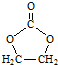 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备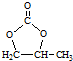 的合成路线(注明必要的反应条件)
的合成路线(注明必要的反应条件)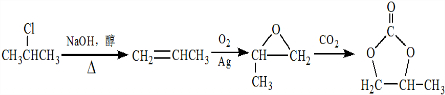 .
.