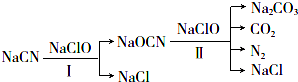题目内容
9.下列离子在溶液中因氧化还原反应而不能大量共存的是( )| A. | Na+Ba2+ SO42- OH- | B. | Ag+ NO3? Cl?K+ | ||
| C. | H+ NO3-Fe2+ K+ | D. | Cu2+NH4+OH- SO42- |
分析 具有氧化性的离子与具有还原性的离子,发生氧化还原反应,则不能大量共存,以此来解答.
解答 解:A.生成硫酸钡沉淀,为复分解反应,故A不选;
B.生成AgCl沉淀,为复分解反应,故B不选;
C.Fe2+、NO3-、H+发生氧化还原反应,不能大量共存,故C选;
D.Cu2+、NH4+分别与OH- 发生复分解反应,不是氧化还原反应,故D不选.
故选C.
点评 本题考查离子的共存,为高频考点,把握常见离子的反应为解答的关键,侧重氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.7.2gXO中含有0.1mol氧原子,则X的相对原子质量为( )
| A. | 21.6 | B. | 28 | C. | 14 | D. | 56 |
17.取两支试管A、B,分别加入5mL 4%、5mL 12%的过氧化氢溶液,再各加入几滴0.2mol/L的氯化铁溶液.下列说法或操作正确的是( )
| A. | 、加入氯化铁的目的是加深溶液颜色,放大实验现象 | |
| B. | 、本实验的目的是研究浓度对双氧水分解速率的影响 | |
| C. | 、本实验过程中A、B试管都不明显,可以将那个很不明显的试管放入热水浴中来观察 | |
| D. | 、小明刚把A药品准备好,就有事情出去了,第二天继续这个实验来进行比较 |
4.25℃时,pH=3的盐酸中由水电离出的H+离子浓度是pH=5的盐酸中由水电离的H+离子浓度的多少倍( )
| A. | 10-2 | B. | 102 | C. | 2 | D. | 12 |
1.乙酸与乙醇的酯化反应中,乙醇的结构简式为 C2H518OH,则反应一段时间后,18O原子存在于( )
| A. | 存在于乙酸的分子中 | B. | 存在于乙醇的分子中 | ||
| C. | 存在于乙酸和乙酸乙酯分子中 | D. | 存在于乙醇和乙酸乙酯分子中 |
18.下列有关说法正确的是( )
| A. | 将pH=10的浓氨水稀释,溶液中所有离子的浓度都减小 | |
| B. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 | |
| D. | pH=3的盐酸和pH=11的氨水等体积混合液中,c(H+)<c(OH-) |
19.下列有关仪器使用方法或实验操作正确的是( )
| A. | 洗净的锥形瓶和容量瓶可以放进烘箱中烘干 | |
| B. | 酸式滴定管装标准溶液前,必须先用该溶液润洗 | |
| C. | 酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差 | |
| D. | 所有玻璃仪器加热时均需垫石棉网 |