题目内容
5.2015年8月12日23:30左右,天津滨海新区某公司仓库发生爆炸,事发仓库里存放了大量的硝酸铵、氰化钠(NaCN)和金属钠等危险化学品.(1)钠在周期表中的位置是第三周期第IA族,实验室少量的钠保存于煤油或石蜡中.
(2)NaCN的电子式是
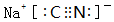 .
.(3)氰化钠是一种重要的化工原料,也是剧毒危险品,皮肤伤口接触、吸入、吞食微量可中毒死亡.氰化钠易溶于水,水溶液呈强碱性.氰化钠泄露可用双氧水或硫代硫酸钠中和.
①用离子方程式表示其水溶液呈强碱性的原因:CN-+H2O?HCN+OH-.
②用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的离子方程式CN-+H2O2+H2O=HCO3-+NH3↑;
③用硫代硫酸钠中和的离子方程式为:CN-+S2O32-=A+SO32-,A为SCN-(填化学式).
④可用纯碱、焦炭、氨气反应制取NaCN,写出反应的化学方程式,并用单线桥标明电子转移的方向和数目
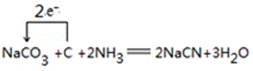 .
.(4)CN-中C元素显+2价,N元素显-3价,则非金属性N>C(填<、=或>),请用简单的实验方法证明(要求说明简单操作、现象和结论):取少量NaHCO3溶液于试管中,加入稀硝酸,有无色气泡生成,说明酸性HNO3>H2CO3,则非金属性N>C.
分析 (1)Na原子核外有3个电子层、最外层电子数是1个电子,主族元素原子核外电子层数与其周期数相等,最外层电子数与其族序数相等;实验室少量的Na保存在煤油和石蜡中;
(2)NaCN中钠离子和氢氰根离子之间存在离子键、C-N原子之间存在共价键;
(3)①NaCN是强碱弱酸盐,氢氰根离子水解导致溶液呈碱性;
②NaCN和双氧水反应生成一种酸式盐为碳酸氢钠,同时生成一种能使湿润的红色石蕊试纸变蓝色的气体为氨气;
③CN-+S2O32-=A+SO32-,根据原子守恒、电荷守恒确定A的化学式;
④纯碱、焦炭、氨气反应生成NaCN,该反应中C元素化合价由0价、+4价变为+2价,转移电子数为2;
(4)在微粒中非金属性较强的元素显负价,非金属性较强的元素显正价,元素的非金属性越强,其最高价氧化物的水化物酸性越强,根据强酸制取弱酸判断非金属性强弱.
解答 解:(1)Na原子核外有3个电子层、最外层电子数是1个电子,主族元素原子核外电子层数与其周期数相等,最外层电子数与其族序数相等,则Na位于第三周期第IA族;实验室少量的Na保存在煤油和石蜡中,
故答案为:第三周期第IA族;煤油或石蜡;
(2)NaCN中钠离子和氢氰根离子之间存在离子键、C-N原子之间存在共价键,NaCN电子式为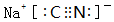 ,
,
故答案为: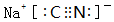 ;
;
(3)①NaCN是强碱弱酸盐,氢氰根离子水解导致溶液呈碱性,水解离子方程式为CN-+H2O?HCN+OH-,
故答案为:CN-+H2O?HCN+OH-;
②NaCN和双氧水反应生成一种酸式盐为碳酸氢钠,同时生成一种能使湿润的红色石蕊试纸变蓝色的气体为氨气,离子方程式为CN-+H2O2+H2O=HCO3-+NH3↑,
故答案为:CN-+H2O2+H2O=HCO3-+NH3↑;
③CN-+S2O32-=A+SO32-,根据原子守恒、电荷守恒确定A的化学式为SCN-,
故答案为:SCN-;
④纯碱、焦炭、氨气反应生成NaCN,该反应中C元素化合价由0价、+4价变为+2价,转移电子数为2,电子转移方向和数目为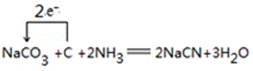 ,
,
故答案为: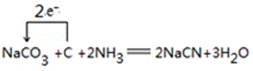 ;
;
(4)在微粒中非金属性较强的元素显负价,非金属性较强的元素显正价,所以非金属性N>C;元素的非金属性越强,其最高价氧化物的水化物酸性越强,根据强酸制取弱酸判断非金属性强弱,其检验方法为:取少量NaHCO3溶液于试管中,加入稀硝酸,有无色气泡生成,说明酸性HNO3>H2CO3,则非金属性N>C,
故答案为:>;取少量NaHCO3溶液于试管中,加入稀硝酸,有无色气泡生成,说明酸性HNO3>H2CO3,则非金属性N>C.
点评 本题考查位置结构性质相互关系及应用,为高频考点,涉及非金属性强弱实验方案设计、氧化还原反应、化学用语等知识点,侧重考查学生知识综合运用能力,易错点是(4)题实验方案设计,注意化学用语的正确运用,题目难度不大.

| A. | FeCl3 | B. | FeCl2 | C. | Fe3O4 | D. | CuCl2 |
?CO(g)+2H2(g)?CH3OH(g)?CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
甲醇与CO的结构式分别如图:
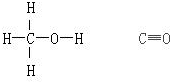
(1)已知反应?中相关化学键键能数据如表:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| 键能(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)温度为110℃条件下,向体积2L的密闭容器充2molCO2与4molH2,发生反应?,10min后达到平衡状态后测得甲醇浓度为0.5mol.L-1.求氢气的反应速率:0.15mol/(L•min).
(3)将甲醇与氧气分别通入如图所示的装置的电极中,可构成甲醇燃料电池,请回答下列问题:
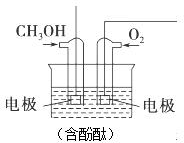
通入甲醇的电极是负(填“正”或“负”)极,反应时该电极附近的现象是溶液红色变浅,溶液中K+向正(填“正”或“负”)极移动:写出正极反应式:O2+2H2O+4e-=4OH-;若电池工作过程中通过2mol电子,则理论上消耗O211.2L(标准状况).
| A. | 升高温度 | B. | 降低压强 | C. | 及时分离出Z | D. | 使用催化剂 |
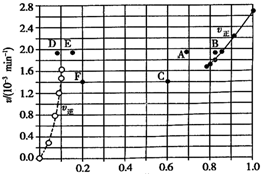 Bodensteins 研究了反应+I2(g)?H2(g)+I2(g)△H=+11kL•mol-1在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
Bodensteins 研究了反应+I2(g)?H2(g)+I2(g)△H=+11kL•mol-1在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:| l/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
| A. | 若升高温度到某一温度,则再次达到平衡时,相应点 可能分別是A、E | |
| B. | 若再次充人a molHI,则达到平衡时,相应点的播坐 标值不变,纵坐标值增大 | |
| C. | 若改变的条件是增大压强,则再次达到平衡时,相应 点与改变条件前相间 | |
| D. | 若改变的条件是使用催化剂.则再次达到平衡时,相 应点与改变条件前不间. |
| A. | 将二氧化硫通入到紫色石蕊溶液中,溶液先变红后褪色 | |
| B. | 原电池工作时负极质量一定减少 | |
| C. | 红热的铁与水蒸气反应生成氧化铁和氢气 | |
| D. | 石油的分馏属于物理变化,煤的干馏属于化学变化 |
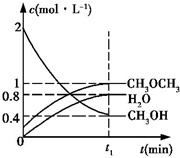 二甲醚是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1
二甲醚是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1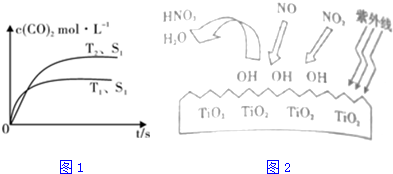
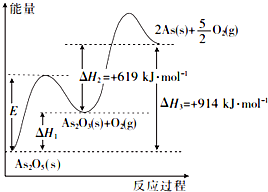 砷的常见酸性氧化物有As2O3和As2O5,根据图中信息回答下列问题:
砷的常见酸性氧化物有As2O3和As2O5,根据图中信息回答下列问题: