题目内容
7.不能用金属单质与非金属单质直接化合而得到的物质是( )| A. | FeCl3 | B. | FeCl2 | C. | Fe3O4 | D. | CuCl2 |
分析 A.铁与氯气反应生成氯化铁;
B.铁在氯气中燃烧生成氯化铁;
C.铁在氧气中燃烧生成四氧化三铁;
D.铜在氯气中燃烧生成氯化铜.
解答 解:A.氯气具有氧化性能氧化变价金属为高价化合物,铁与氯气反应生成氯化铁,故A正确;
B.铁为变价金属,在强氧化剂氯气中燃烧生成高价化合物氯化铁,不能生成氯化亚铁,故B错误;
C.铁在氧气中燃烧生成四氧化三铁,故C正确;
D.铜与氯气化合生成氯化铜,故D正确;
故选B.
点评 本题考查了氯气的性质,题目难度不大,明确氯气具有强的氧化性,与变价金属反应得到高价态氯化物是解题关键.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
17.下列烷烃分子中,一氯取代产物最多的是( )
| A. | 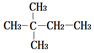 | B. | 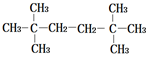 | ||
| C. | CH3CH2CH2CH2CH2CH3 | D. | CH3CH2CH2CH2CH2CH2CH3 |
18.下列各组物质中,互为同分异构体的是( )
| A. | 葡萄糖和果糖 | B. | 淀粉和纤维素 | C. | 核糖和脱氧核糖 | D. | 丙氨酸、甘氨酸 |
15.下列实验操作和数据记录都正确的是( )
| A. | 用25mL碱式滴定管量取高锰酸钾溶液,体积为16.60mL | |
| B. | 用标准NaOH溶液滴定未知浓度盐酸,用去NaOH溶液20.50mL | |
| C. | 用10mL量筒量取8.25mL盐酸 | |
| D. | 用普通pH试纸测得某溶液pH为3.2 |
2.在溶液中能大量共存,加入OH-有沉淀产生,加入H+有气体放出的是( )
| A. | Na+、Cu2+、Cl-、SO42- | B. | Fe3+、K+、SO42-、NO3- | ||
| C. | H+、Mg2+、OH-、NO3- | D. | Na+、Ca2+、Cl-、HCO3- |
12.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图: | B. | 氯化镁的电子式: | ||
| C. | N2的电子式: | D. | 氯化氢分子的形成过程: |
7.氨是生产硝酸、尿素等物质的重要原料,工业合成氨是最重要的化工生产之一.
(1)氨催化氧化法是工业制硝酸的主要方法.已知:2NO(g)+3H2(g)?2NH3(g)+O2(g)△H1=-272.9 kJ•mol-1,2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ•mol-1,则4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-905.0 kJ/mol.
(2)恒容密闭容器中进行合成氨反应N2(g)+3H2(g)?2NH3(g)△H4=-92.4 kJ•mol-1,其化学平衡常数(K)与温度的关系如表:
K1> (填“>”或“<”)K2,其判断理由是反应是放热反应,温度升高,平衡逆向进行,平衡常数减小.
(3)向氨合成塔中充入10molN2和40mol H2进行氨的合成,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示.下列说法正确的是AB(填字母).
A.由图1可知增大体系压强(p),有利于增大氨气在混合气体中的体积分数
B.若图1中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
当温度为T、氨气的体积分数为25%时,N2的转化率为50%.
(4)电化学法是合成氨的一种新方法,其原理如图2所示,通入H2的一极为阳极(填“阴极”或“阳极”),阴极得电极反应式是N2+6H++6e-=2NH3.
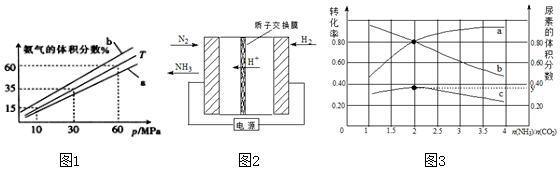
(5)氨碳比[$\frac{n(N{H}_{3})}{C{O}_{2}}$]对合成尿素的反应:2NH3(g)+CO2(g)?CO(NH2)2(g)+H2O(g)有影响,T℃时,在一体积为2L地 恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图3所示,a,b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数,$\frac{n(N{H}_{3})}{C{O}_{2}}$=2时,尿素的产量最大;该条件下反应的平衡常数K=40.
(1)氨催化氧化法是工业制硝酸的主要方法.已知:2NO(g)+3H2(g)?2NH3(g)+O2(g)△H1=-272.9 kJ•mol-1,2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ•mol-1,则4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-905.0 kJ/mol.
(2)恒容密闭容器中进行合成氨反应N2(g)+3H2(g)?2NH3(g)△H4=-92.4 kJ•mol-1,其化学平衡常数(K)与温度的关系如表:
温度/K | 298 | 398 | 498 | … |
| 平衡常数(K) | 4.1×105 | K1 | K2 | … |
(3)向氨合成塔中充入10molN2和40mol H2进行氨的合成,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示.下列说法正确的是AB(填字母).
A.由图1可知增大体系压强(p),有利于增大氨气在混合气体中的体积分数
B.若图1中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
当温度为T、氨气的体积分数为25%时,N2的转化率为50%.
(4)电化学法是合成氨的一种新方法,其原理如图2所示,通入H2的一极为阳极(填“阴极”或“阳极”),阴极得电极反应式是N2+6H++6e-=2NH3.

(5)氨碳比[$\frac{n(N{H}_{3})}{C{O}_{2}}$]对合成尿素的反应:2NH3(g)+CO2(g)?CO(NH2)2(g)+H2O(g)有影响,T℃时,在一体积为2L地 恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图3所示,a,b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数,$\frac{n(N{H}_{3})}{C{O}_{2}}$=2时,尿素的产量最大;该条件下反应的平衡常数K=40.
4.丙烷制备丙烯已成为制备丙烯的重要方法之一.
方法 I:丙烷脱氢制丙烯:
①C3H8(g)$?_{△}^{催化剂}$ C3H6(g)+H2(g)△H1
方法 II:丙烷氧化脱氢制丙烯:(投料为C3H8和CO2)
②C3H8(g)+CO2(g) $?_{△}^{催化剂}$ C3H6(g)+CO(g)+H2O(g)△H2=165kJ•mol-1
③CO2(g)+H2(g) $?_{△}^{催化剂}$ CO(g)+H2O(g)△H3=41kJ•mol-1
已知:
(1)计算△H1=124kJ•mol-1
(2)模拟方法 I制丙烯,在体积可变的反应器中,恒温,维持体系总压强恒定为0.1MPa,加入1mol C3H8(g)时体积为50L,再加入8.5mol水蒸汽作为稀释剂,反应t分钟达到平衡,测得丙烷0.5mol,已知:分压=物质的量分数×总压强.
①计算该温度下反应I的平衡常数K=0.005MPa(KP)或0.001(KC).
②常压下,温度为600K~1000K,水烃比M=10(水烃比是指投料中水蒸汽和丙烷的物质的量之比)时丙烷脱氢平衡转化率与温度变化的曲线如图1,在图1中画出水烃比M=8时的曲线.
(3)模拟方法 II制丙烯,在恒温恒容条件下充入物质的量之比为1:1的丙烷和二氧化碳气体,一段时间后达到平衡,则下列可以判断容器内反应体系达到平衡的是AB.
A.v正(C3H8)=v逆(C3H6) B.平均相对分子质量不再变化
C.气体密度不再变化 D.丙烷和二氧化碳的物质的量比值不再变化
(4)在相同条件下模拟方法 I与方法 II,测得丙烷的平衡转化率与温度的关系如图2所示,图2中方法 II对应的曲线是M(填“M”或“N”),从化学平衡的角度解释丙烷平衡转化率M高于N的原因方法 II 可看成是发生反应①和反应③,由于反应③会消耗氢气,使得反应①的化学平衡向右移动.
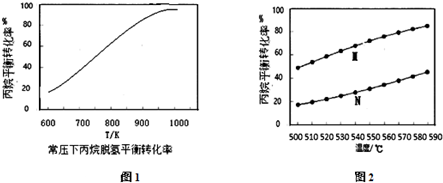
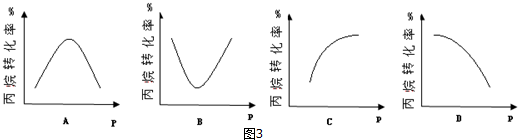
(5)恒温,密闭容器中投入丙烷发生反应①,某压强下反应t时刻后测得丙烷的转化率,然后保持其它初始实验条件不变,分别在不同压强下,重复上述实验,经过相同时间测得丙烷的转化率随压强变化趋势图可能图3中的是ACD.
方法 I:丙烷脱氢制丙烯:
①C3H8(g)$?_{△}^{催化剂}$ C3H6(g)+H2(g)△H1
方法 II:丙烷氧化脱氢制丙烯:(投料为C3H8和CO2)
②C3H8(g)+CO2(g) $?_{△}^{催化剂}$ C3H6(g)+CO(g)+H2O(g)△H2=165kJ•mol-1
③CO2(g)+H2(g) $?_{△}^{催化剂}$ CO(g)+H2O(g)△H3=41kJ•mol-1
已知:
| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
(2)模拟方法 I制丙烯,在体积可变的反应器中,恒温,维持体系总压强恒定为0.1MPa,加入1mol C3H8(g)时体积为50L,再加入8.5mol水蒸汽作为稀释剂,反应t分钟达到平衡,测得丙烷0.5mol,已知:分压=物质的量分数×总压强.
①计算该温度下反应I的平衡常数K=0.005MPa(KP)或0.001(KC).
②常压下,温度为600K~1000K,水烃比M=10(水烃比是指投料中水蒸汽和丙烷的物质的量之比)时丙烷脱氢平衡转化率与温度变化的曲线如图1,在图1中画出水烃比M=8时的曲线.
(3)模拟方法 II制丙烯,在恒温恒容条件下充入物质的量之比为1:1的丙烷和二氧化碳气体,一段时间后达到平衡,则下列可以判断容器内反应体系达到平衡的是AB.
A.v正(C3H8)=v逆(C3H6) B.平均相对分子质量不再变化
C.气体密度不再变化 D.丙烷和二氧化碳的物质的量比值不再变化
(4)在相同条件下模拟方法 I与方法 II,测得丙烷的平衡转化率与温度的关系如图2所示,图2中方法 II对应的曲线是M(填“M”或“N”),从化学平衡的角度解释丙烷平衡转化率M高于N的原因方法 II 可看成是发生反应①和反应③,由于反应③会消耗氢气,使得反应①的化学平衡向右移动.

(5)恒温,密闭容器中投入丙烷发生反应①,某压强下反应t时刻后测得丙烷的转化率,然后保持其它初始实验条件不变,分别在不同压强下,重复上述实验,经过相同时间测得丙烷的转化率随压强变化趋势图可能图3中的是ACD.

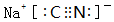 .
.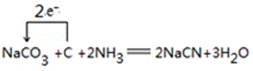 .
.