题目内容
8.某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质.某化学课外小组设计如图流程,取该矿样为原料生产CuC12•2H2O 晶体.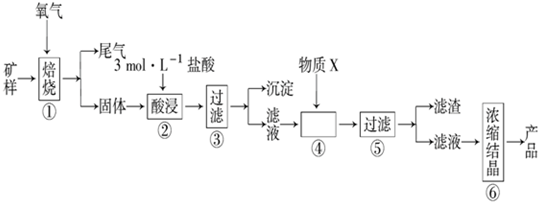
已知:常温下,金属离子开始沉淀和沉淀完全时的pH 如表.
| 金属 离子 | 氢氧化物开始沉淀的pH | 氢氧化物沉淀完全的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
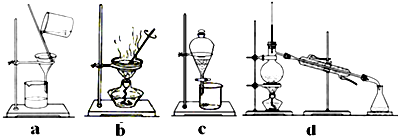
(l)步骤①的焙烧过程中需要通入氧气.在实验室中,可使用常见化学物质利用如图所示装置制取氧气,试写出熟悉的符合上述条件的两个化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2 ↑、2Na2O2+2H2O=4NaOH+O2↑.
(2)焙烧产生的尾气中含有的一种气体是形成酸雨的污染物,若将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:2(NH4)2SO3+O2═2(NH4)2SO4、2NH4HSO3+O2═2NH4HSO4.
(3)步骤②酸浸过程中,需要用到3mol•L-1的盐酸100mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有100ml的容量瓶,量筒.
(4)步骤④加入物质X的目的是控制溶液的pH,使Fe3+以沉淀的形式全部沉淀,物质X 可以选用下列物质中的D.
(A)氢氧化钠 (B)稀盐酸 (C)氨水 (D)氧化铜
(5)当溶液中金属离子浓度低于1×10-5 mol•L-1时,认为该金属离子沉淀完全,则Ksp[Fe(OH)2]=1×10-15.
分析 矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质,在氧气中焙烧,产生二氧化硫尾气,得到的固体为铜、铁的氧化物,用酸浸过滤,得滤液中含有铜离子和铁离子,在滤液中加入X调节溶液的PH值,使铁离子水解产生沉淀而除去,为了不引入新的杂质,可用氧化铜,故X为氧化铜,过滤得氯化铜溶液,将溶液进行浓缩结晶可得氯化铜晶体,
(1)步骤①的焙烧过程中需要通入氧气,装置是快速制氧气的装置,所以分液漏斗中加入锥形瓶中发生反应生成氧气;
(2)二氧化硫中的硫为+4价,具有还原性,空气中的氧气具有氧化性;
(3)配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器依据配制溶液的步骤;
(4)步骤④加入物质X的目的是控制溶液的PH,使Fe3+以沉淀的形式全部沉淀,物质X是和溶液中酸反应调节溶液PH,但不能引入新的杂质;
(5)根据题意,溶液中PH值在9.0时,亚铁离子沉淀完全,根据Ksp[Fe(OH)2]=c(Fe2+)•c2(OH-)计算.
解答 解:(1)步骤①的焙烧过程中需要通入氧气,装置是快速制氧气的装置,所以分液漏斗中加入锥形瓶中发生反应生成氧气,反应的化学方程式为:
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2 ↑、2Na2O2+2H2O=4NaOH+O2↑,故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2 ↑、2Na2O2+2H2O=4NaOH+O2↑;
(2)将尾气通入氨水中,尾气中的SO2与氨水反应,氨水少量时:SO2+NH3•H2O=NH4HSO3;氨水过量时:SO2+2NH3•H2O=(NH4)2SO3+H2O,生成的盐中硫的化合价为+4价,遇氧化剂氧气能升高到+6价,
故答案为:2(NH4)2SO3+O2═2(NH4)2SO4;2NH4HSO3+O2═2NH4HSO4;
(3)配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有100ml的容量瓶,量筒;故答案为:100ml的容量瓶,量筒;
(4)步骤④加入物质X的目的是控制溶液的PH,使Fe3+以沉淀的形式全部沉淀,物质X是和溶液中酸反应调节溶液PH,但不能引入新的杂质,所以:
A、加入氢氧化钠后,引入钠离子杂质,故A不符合;
B、稀盐酸引入了氯离子,故B不符合;
C、氨水加入引入铵根离子,故C不符合;
D、氧化铜难溶于水,加入到溶液中和酸反应调节pH,使三价铁离子全部沉淀,且不引入杂质,故D符合;
故选D.
故答案为:控制溶液的pH,使Fe3+以沉淀的形式全部沉淀;D;
(5)根据题意,溶液中PH值在9.0时,亚铁离子沉淀完全,此时溶液中c(OH-)=1×10-5 mol/L,c(Fe2+)=1×10-5 mol•L-1,所以Ksp[Fe(OH)2]=c(Fe2+)•c2(OH-)=1×10-5×(1×10 -5)2 =1×10-15,故答案为:1×10-15.
点评 本题考查了物质转化关系和物质性质的应用,主要考查物质分离的流程分析和原理利用,溶液配制,防倒吸的选择,实验基本操作的判断.

 阅读快车系列答案
阅读快车系列答案| A. | Z2与X-在水溶液中不能大量共存 | |
| B. | 还原性:Y->Z->W- | |
| C. | 2NaW+Y2=2NaY+W2 | |
| D. | W2通入到NaX和NaY的混合溶液中:W2优先氧化Y- |
| A. | 二溴乙烷  | B. | 3-乙基-1-丁烯  | ||
| C. | 2-甲基-2,4-己二烯  | D. | 2,2,3-三甲基戊烷  |
| A. | 乙烯和乙炔属于不饱和烃,乙烷属于饱和烃 | |
| B. | 乙烯和乙炔分子中所有原子都在同一平面上,乙烷分子中所有原子不都在同一平面上 | |
| C. | 乙烯和乙炔都能发生加成反应,乙烷不能发生加成反应 | |
| D. | 在发生加成反应时,乙烯和乙炔分子中的碳碳键全部断裂 |
①液态HF中存在氢键,所以其分子比HCl更稳定
②将SO2通入紫色石蕊溶液,溶液先变红后褪色
③可用浓氨水检验输送氯气的管道是否有泄漏
④在Fe(NO3)2溶液中通入过量碘化氢气体,最终Fe2+被氧化为Fe3+
⑤将过量的二氧化碳气体通入硅酸钠溶液中,然后加热蒸干,再在高温下充分灼烧最后得到的固体为碳酸钠和二氧化硅.
| A. | ①②⑤ | B. | ②③④ | C. | ①②④⑤ | D. | ①③④⑤ |
| A. | NaCl和HCl溶于水都电离成离子 | B. | SiO2和冰块的熔化 | ||
| C. | 晶体硫的熔化和晶体碘的升华 | D. | 酒精和冰醋酸溶于水 |