题目内容
A→J均由短周期元素组成,E、F、H为单质(其中有一种为金属)其余为化合物.且E+H→B,常温下B为液体;它们之间具有下图所示的相互转化关系:

(1)D中含有的化学键: ;
(2)写出下列反应的离子方程式:
③ ;
⑤ ;
(3)E、F和海水可制成新型“海洋电池”,可作为航标灯电源.该电池的电极材料为 ;其正极的电极反应式为 .

(1)D中含有的化学键:
(2)写出下列反应的离子方程式:
③
⑤
(3)E、F和海水可制成新型“海洋电池”,可作为航标灯电源.该电池的电极材料为
考点:无机物的推断
专题:推断题
分析:A→J均由短周期元素组成,E、F、H为单质(其中有一种为金属)其余为化合物.由反应④可知,F为金属,可推知H为H2,由于E+H→B,且常温下B为液体,可推知E为O2、B为H2O,由反应①可知,A为Na2O2,D为NaOH,金属F能与NaOH溶液反应生成氢气与G,可推知F为Al,G为NaAlO2,I为AlCl3,由反应⑤可知J为Al(OH)3,由反应②可知C为Al2O3,据此解答.
解答:
解:A→J均由短周期元素组成,E、F、H为单质(其中有一种为金属)其余为化合物.由反应④可知,F为金属,可推知H为H2,由于E+H→B,且常温下B为液体,可推知E为O2、B为H2O,由反应①可知,A为Na2O2,D为NaOH,金属F能与NaOH溶液反应生成氢气与G,可推知F为Al,G为NaAlO2,I为AlCl3,由反应⑤可知J为Al(OH)3,由反应②可知C为Al2O3,
(1)由上述分析可知,D为NaOH,属于离子化合物,钠离子与氢氧根离子之间形成离子键、氢氧根离子在O原子与H原子之间形成极性键,
故答案为:离子键、极性键;
(2)反应③的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,反应⑤的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)氧气、Al和海水可制成新型“海洋电池”,可作为航标灯电源,本质为金属吸氧腐蚀,该电池的电极材料为Al、石墨,氧气在正极上获得电子生成氢氧根离子,正极电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:Al、石墨;O2+2H2O+4e-=4OH-.
(1)由上述分析可知,D为NaOH,属于离子化合物,钠离子与氢氧根离子之间形成离子键、氢氧根离子在O原子与H原子之间形成极性键,
故答案为:离子键、极性键;
(2)反应③的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,反应⑤的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)氧气、Al和海水可制成新型“海洋电池”,可作为航标灯电源,本质为金属吸氧腐蚀,该电池的电极材料为Al、石墨,氧气在正极上获得电子生成氢氧根离子,正极电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:Al、石墨;O2+2H2O+4e-=4OH-.
点评:本题考查无机物推断,“单质E+单质H→B,且常温下B为液体”及“单质F+盐酸→单质H”是推断突破口,难度不大,需要学生熟练掌握元素化合物知识,注意对基础知识的全面掌握.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
设NA为阿佛加德罗常数的数值,下列说法正确的是( )
| A、78 g Na2O2中含有的阴离子数为2NA |
| B、1.0 L 1.0 mo1/L的NaAlO2水溶液中含有的氧原子数为2NA |
| C、8.2 g Na218O2与足量的CO2和H2O(g)的混合气体充分反应后转移电子数为0.1NA |
| D、NA个Fe(OH)3胶体粒子的质量为107g |
甲醛(CH2O)、乙酸(C2H4O2)、和丙酸(C3H6O2)组成的混合物中,氧元素的质量分数为44%,则碳元素的质量分数为( )
| A、44% | B、48% |
| C、56% | D、无法计算 |
物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2?2(t-BuNO).在20℃时,向2L正庚烷中加入(t-BuNO)2 1.0mol,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为75%(假设反应过程中溶液体积始终为2L).下列说法正确的是( )
| A、反应在前10min内的平均速率为ν(t-BuNO)=0.0375mol?L-1?min-1 |
| B、保持其他条件不变,若此时再向正庚烷反应体系中加入正庚烷,平衡向生成(t-BuNO)2的方向移动 |
C、保持其他条件不变,升高温度,(t-BuNO)2的平衡转化率大于75%,则其能量关系可用图表示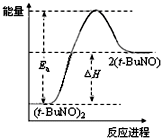 |
| D、保持其他条件不变,若该反应在CCl4中进行,其平衡常数为1.9,则(t-BuNO)2的平衡转化率大于75% |
以下离子方程式的书写正确的是( )
| A、氧化铁和稀盐酸:FeO+2H+=Fe2++H2O |
| B、向NaOH溶液中通Cl2:2OH-+Cl2=Cl-+ClO-+H2O |
| C、向AlCl3溶液中加过量强碱:Al3++3OH-=Al(OH)3↓ |
| D、给漂白粉溶液中加入盐酸:Ca(ClO2)+2H+=2HClO+Ca2+ |
 2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒.
2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒.

 右图是铜与稀硝酸反应的实验装置图,请回答下列问题:
右图是铜与稀硝酸反应的实验装置图,请回答下列问题: