题目内容
请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”).
(2)将100mL 0.1mol?L-1的CH3COOH溶液与50mL 0.2mol?L-1的NaOH溶液混合,所得溶液呈 性,原因是 (用离子方程式表示).
(3)0.1mol?mol-1的氨水溶液中存在电离平衡NH3+H2O?NH3?H2O?NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
[第①行填“向左”、“向右”或“不移动”第②行填“增大”、“减小”或“不变”].
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸
(2)将100mL 0.1mol?L-1的CH3COOH溶液与50mL 0.2mol?L-1的NaOH溶液混合,所得溶液呈
(3)0.1mol?mol-1的氨水溶液中存在电离平衡NH3+H2O?NH3?H2O?NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
| 条件的变化 | 通氨气 | 加水 | 加NH4Cl(s) | |
| ① | 电离平衡移动的方向 | |||
| ② | c(OH-)的变化 |
考点:弱电解质在水溶液中的电离平衡,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)醋酸是弱电解质,在水溶液里存在电离平衡,氯化氢是强电解质,不存在电离平衡,所以向等pH的盐酸和醋酸中加水稀释,能促进醋酸电离,根据溶液中氢离子浓度判断其pH的关系;
(2)CH3COOH与NaOH的物质的量相同,恰好反应生成CH3COONa,CH3COO-水解显碱性;
(3)0.1mol?mol-1的氨水溶液中存在电离平衡NH3+H2O?NH3?H2O?NH4++OH-,通氨气平衡正移,溶液中c(OH-)增大;加水促进电离平衡正移,c(OH-)减小;加NH4Cl(s),溶液中c(NH4+)增大,平衡逆移.
(2)CH3COOH与NaOH的物质的量相同,恰好反应生成CH3COONa,CH3COO-水解显碱性;
(3)0.1mol?mol-1的氨水溶液中存在电离平衡NH3+H2O?NH3?H2O?NH4++OH-,通氨气平衡正移,溶液中c(OH-)增大;加水促进电离平衡正移,c(OH-)减小;加NH4Cl(s),溶液中c(NH4+)增大,平衡逆移.
解答:
解:(1)醋酸是弱电解质,氯化氢是强电解质,因为醋酸中存在电离平衡,盐酸中不存在电离平衡,加水稀释促进醋酸电离,所以加等体积的水稀释等pH的醋酸和盐酸,稀释后的醋酸溶液中C(H+)大于盐酸溶液中C(H+),所以醋酸的pH小于盐酸,即溶液的pH:盐酸>醋酸;
故答案为:>;
(2)CH3COOH与NaOH的物质的量相同,恰好反应生成CH3COONa,CH3COO-水解显碱性,其水解方程式为:CH3COO-+H2O?CH3COOH+OH-;
故答案为:碱;CH3COO-+H2O?CH3COOH+OH-;
(3)0.1mol?L-1的氨水溶液中存在电离平衡NH3+H2O?NH3?H2O?NH4++OH-,通氨气平衡向右移动,溶液中c(OH-)增大;加水促进电离平衡向右移动,由于溶液体积的变化大于平衡移动引起的氢氧根离子的物质的量的变化,所以c(OH-)减小;加NH4Cl(s),溶液中c(NH4+)增大,平衡向左移动,溶液中c(OH-)减小;
故答案为:
.
故答案为:>;
(2)CH3COOH与NaOH的物质的量相同,恰好反应生成CH3COONa,CH3COO-水解显碱性,其水解方程式为:CH3COO-+H2O?CH3COOH+OH-;
故答案为:碱;CH3COO-+H2O?CH3COOH+OH-;
(3)0.1mol?L-1的氨水溶液中存在电离平衡NH3+H2O?NH3?H2O?NH4++OH-,通氨气平衡向右移动,溶液中c(OH-)增大;加水促进电离平衡向右移动,由于溶液体积的变化大于平衡移动引起的氢氧根离子的物质的量的变化,所以c(OH-)减小;加NH4Cl(s),溶液中c(NH4+)增大,平衡向左移动,溶液中c(OH-)减小;
故答案为:
| 条件的变化 | 通氨气 | 加水 | 加NH4Cl(s) |
| 电离平衡移动的方向 | 向右 | 向右 | 向左 |
| c(OH-)的变化 | 增大 | 减小 | 减小 |
点评:本题考查弱电解质电离平衡移动,盐的水解等,注意根据平衡移动和溶液体积的变化来分析溶液中离子浓度变化,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
一定浓度l00mL的HNO3溶液中加入2.8g Fe,全部溶解,得到标准状况下的NO气体1.12L,测得反应后溶液中的c(H+)=0.1mol/L.若反应前后溶液体积变化忽略不计,则下列有关判断错误的是( )
| A、反应后溶液中无硝酸亚铁 |
| B、反应前HNO3溶液的浓度为2.0mol?L-1 |
| C、反应后溶液中c(NO3-)=1.6mol?L-1 |
| D、反应后的溶液最多还能溶解1.61g Fe |
常温常压下,某烧碱溶液与0.05mol氯气恰好完全反应,得到pH=9的混合溶液(溶质为NaCl与NaC1O).下列说法正确的是(NA代表阿伏伽德罗常数)( )
| A、氯气的体积为1.12L |
| B、原烧碱溶液中含溶质离子0.2NA |
| C、所得溶液中含OH-的数目为1×10-5NA |
| D、所得溶液中C1O-的数目为0.05NA |
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S.
已知:CO(g)+
O2(g)═CO2(g)△H=-283.0kJ/mol
S(g)+O2(g)═SO2(g)△H=-296.0kJ/mol
下列说法不正确的是( )
已知:CO(g)+
| 1 |
| 2 |
S(g)+O2(g)═SO2(g)△H=-296.0kJ/mol
下列说法不正确的是( )
| A、两个反应均为氧化还原反应 |
| B、CO2与SO2可以用澄清石灰水鉴别 |
| C、CO2分子中各原子最外层均为8电子稳定结构 |
| D、相同条件下:2CO(g)+SO2(g)═S(g)+2CO2(g)△H=-270kJ/mol |

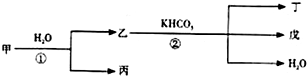 甲、乙、丙、丁、戊几种中学常见的物质在常温有如图转化关系,在转化过程中,乙与KHCO3按等物质的量混合,并且恰好完全反应.
甲、乙、丙、丁、戊几种中学常见的物质在常温有如图转化关系,在转化过程中,乙与KHCO3按等物质的量混合,并且恰好完全反应.