题目内容
15.同温同压下,等质量的SO2与CO2相比较,密度之比为16:11体积之比为11:16.分析 根据阿伏伽德罗定律可知,同温同压下,气体体积与物质的量成正比,再根据m=nM可知,气体物质的量与摩尔质量成正比,则气体体积之比与摩尔质量成反比;相同条件下密度与摩尔质量成正比,据此进行解答.
解答 解:同温同压下,气体的密度与摩尔质量成正比,则SO2与CO2的密度之比=64g/mol:44g/mol=16:11;
等质量的SO2与CO2的物质的量之比与摩尔质量成正比,则其物质的量之比=44g/mol:64g/mol=11:16,根据阿伏伽德罗定律可知,相同条件下气体体积之比等于其物质的量之比,则同温同压下,等质量的SO2与CO2的体积之比=11:16,
故答案为:16:11;11:16.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积之间的关系为解答关键,试题侧重基础知识的考查,有利于培养学生的化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列化学式只表示一种纯净物的是( )
| A. | C2H4 | B. | C4H10 | C. | C2H4Br2 | D. | C3H6O |
6.下表是元素周期表的一部分,针对表中的①~⑧中元素,填空回答.
(1)写出下列元素的名称②氮④钠⑥硅
(2)在这些元素中,化学性质最不活泼的原子的原子结构示意图为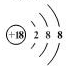 .
.
(3)③⑤⑦元素原子半径由大到小的顺序是Al>Cl>F(填元素符号).
(4)某元素三价阳离子的核外有10个电子,该元素是铝(填元素名称).
(5)④的单质与水反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑.
(6)⑦元素的单质常温下的颜色是黄绿色,用电子式表示⑦元素的氢化物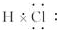 .
.
(7)写出元素⑤的氢氧化物与NaOH溶液反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)在这些元素中,化学性质最不活泼的原子的原子结构示意图为
 .
.(3)③⑤⑦元素原子半径由大到小的顺序是Al>Cl>F(填元素符号).
(4)某元素三价阳离子的核外有10个电子,该元素是铝(填元素名称).
(5)④的单质与水反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑.
(6)⑦元素的单质常温下的颜色是黄绿色,用电子式表示⑦元素的氢化物
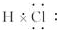 .
.(7)写出元素⑤的氢氧化物与NaOH溶液反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
3.在下列条件下,可能大量共存的离子组是( )
| A. | c(H+)=1×10-14mol/L的溶液:K+、Cu2+、I-、SO42- | |
| B. | 水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 能与K3[Fe(CN)6]产生蓝色沉淀的溶液:H+、Na+、SO42-、CrO42- |
10.下列有关实验操作、现象及结论描述正确的是( )
| 选项 | 实验操作及现象 | 结论 |
| A | 用铂丝蘸取某待测液在酒精灯外焰上灼烧,火焰呈紫色(透过蓝色钴玻璃) | 待测试液中一定含有钾元素, 可能含钠元素 |
| B | 向某无色溶液中通入过量的CO2气体,有白色沉淀产生 | 该溶液中一定含有SiO32- |
| C | 向品红溶液中通入某气体后,溶液褪色 | 该气体一定是SO2 |
| D | 向NaOH溶液中滴加MgCl2溶液,产生白色沉淀,继续滴加FeCl3溶液产生红褐色沉淀 | Fe(OH)3的溶解度大于Mg(OH)2的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
20.如图是锌锰电池的内部结构示意图,下列说法错误的是( )
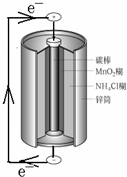

| A. | 锌筒作负极,发生氧化反应 | |
| B. | 电子从锌流向碳棒,碳棒得电子被还原 | |
| C. | 电池内部的NH4+向碳棒移动 | |
| D. | 将NH4Cl更换为KOH能提高电池寿命和性能 |
7.下列各对物质中属于同分异构体的是( )
| A. | CH3CH2CH3与 | B. | CH2=CH2与 | ||
| C. |  与 与 | D. |  与 与 |
 工业上可利用乙烯和水在催化剂、加热和加压条件下反应制备乙醇,实验室中可利用乙醇和浓硫酸(浓硫酸的作用是催化剂和脱水剂)在170℃的温度下反应制备乙烯
工业上可利用乙烯和水在催化剂、加热和加压条件下反应制备乙醇,实验室中可利用乙醇和浓硫酸(浓硫酸的作用是催化剂和脱水剂)在170℃的温度下反应制备乙烯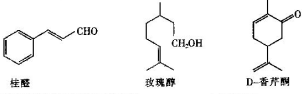
 .
.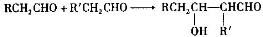
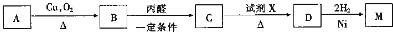
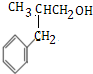 ;
; .
.