题目内容
10.X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14.下列说法正确的是( )| A. | 原子半径由小到大的顺序:X<Y<Z<W | |
| B. | Z的最高价氧化物能与水反应生成相应的酸 | |
| C. | 室温下,0.1 mol/L W的气态氢化物的水溶液的pH>1 | |
| D. | Y单质在一定条件下可以与氧化铁发生置换反应 |
分析 X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,则Y为Al,Z原子的最外层电子数是次外层电子数的一半,则Z为Si元素,X与Z位于同一主族,可知X为C元素,Y、Z、W原子的最外层电子数之和为14,则W的最外层电子数为14-3-4=7,则W为Cl,然后结合元素周期律及元素化合物知识来解答.
解答 解:X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,则Y为Al,Z原子的最外层电子数是次外层电子数的一半,则Z为Si元素,X与Z位于同一主族,可知X为C元素,Y、Z、W原子的最外层电子数之和为14,则W的最外层电子数为14-3-4=7,则W为Cl,
A.电子层越多原子半径越大,同周期原子序数大的原子半径小,则原子半径由小到大的顺序:X<W<Z<Y,故A错误;
B.Z的最高价氧化物为二氧化硅,与水不反应,故B错误;
C.室温下,0.1 mol/L W的气态氢化物的水溶液为盐酸,其pH=1,故C错误;
D.Y单质在一定条件下可以与氧化铁发生置换反应生成Fe和氧化铝,为铝热反应,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素化合物知识与原子结构推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
1.下列叙述正确的是( )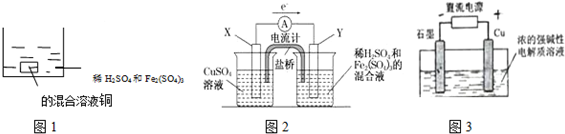

| A. | 如图1 所示将一定量的铜片加入到100 mL 稀硫酸和硫酸铁的混合溶液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶液中c(SO42-)为0.5mol/L | |
| B. | 如图2 所示的装置中发生Cu+2Fe3+═Cu2++2Fe2+的反应,X 极是负极,Y 极的材料名称可以是铜 | |
| C. | Cu2O 是一种半导体材料,基于绿色化学理念设计的制取.Cu2O 的电解池示意图如图3所示,石墨电极上产生氢气,铜电极发生还原反应 | |
| D. | 如图3 所示当有0.1mol 电子转移时,有0.1molCu2O 生成 |
18.下列反应中,属于加成反应的是( )
| A. | SO3+H2O=H2SO4 | B. | CH2=CH2+HClO→CH3-CHOH | ||
| C. | CH3Cl+Cl2→CH2Cl2+HCl | D. | CO2+2NaOH=Na2CO3+H2O |
5.下列化学式只表示一种纯净物的是( )
| A. | C2H4 | B. | C4H10 | C. | C2H4Br2 | D. | C3H6O |
15.下面列举的是某化合物的组成和性质,能说明该物质肯定是有机物的是( )
| A. | 仅由碳、氢两种元素组成 | B. | 仅由碳、氢、氧三种元素组成 | ||
| C. | 在氧气中燃烧只生成二氧化碳 | D. | 熔点低而且难溶于水 |
2.全钒电池以惰性材料作电极,在电解质溶液中发生的电池总反应为:VO2+(蓝色)+H2O+V3+(紫色)$?_{放电}^{充电}$VO2+(黄色)+V2+(绿色)+2H+下列说法错误的( )
| A. | 充电时,反应每生成2mol H+时电子转移的物质的量为2mol | |
| B. | 放电过程中,正极附近溶液的酸性减弱 | |
| C. | 放电时,正极反应为VO2++2H++e-=VO2++H2O | |
| D. | 充电时,阳极附近溶液由蓝色逐渐变为黄色 |
19.下列各组反应(表中物质均为反应物),反应刚开始时,放出H2的速率最大的是( )
| 编号 | 金属(粉末状)(mol) | 酸的浓度及体积 | 反应温度(℃) |
| A | Mg,0.1 | 6mol•L-1硝酸10mL | 60 |
| B | Mg,0.1 | 3mol•L-1盐酸10mL | 60 |
| C | Fe,0.1 | 3mol•L-1盐酸100mL | 60 |
| D | Mg,0.1 | 3mol•L-1硫酸5mL | 60 |
| A. | A | B. | B | C. | C | D. | D |
20.如图是锌锰电池的内部结构示意图,下列说法错误的是( )
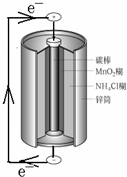

| A. | 锌筒作负极,发生氧化反应 | |
| B. | 电子从锌流向碳棒,碳棒得电子被还原 | |
| C. | 电池内部的NH4+向碳棒移动 | |
| D. | 将NH4Cl更换为KOH能提高电池寿命和性能 |