题目内容
9.SO2能使溴水褪色,说明SO2具有( )| A. | 还原性 | B. | 漂白性 | C. | 酸性 | D. | 氧化性 |
分析 氧化还原反应中元素化合价升高,体现还原性,溴与二氧化硫二者能发生氧化还原反应生成硫酸和HBr,使溴水褪色,硫元素化合价升高,体现还原性.
解答 解:溴与二氧化硫二者能发生氧化还原反应生成硫酸和HBr,溶液中溴的颜色会褪去,反应的化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr,硫元素化合价升高(+4→+6),体现还原性,溴元素化合价降低,体现氧化性(0→-1),
故选A.
点评 本题主要考查了二氧化硫的性质,侧重考查二氧化硫的还原性,注意中间价态的元素既有氧化性又有还原性,同种元素相邻价态间不发生氧化还原反应,题目难度不大.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
19.某老师批阅学生实验报告,下列哪些学生是以科学的态度记录实验数据的( )
| A. | 甲学生用电子天平称取NaOH固体1.220g | |
| B. | 乙学生用广泛pH试纸测定溶液的酸碱性:pH=14.5 | |
| C. | 丙学生用碱式滴定管取25.0mL0.lmol/L的盐酸 | |
| D. | 丁学生用50mL 量筒量取46.70mL浓盐酸 |
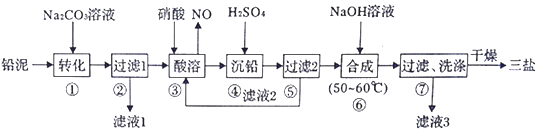
20.钴(Co)是重要的稀有金属,在工业和科技领域具有广泛的用途.从某含钴工业废料中回收钴的工艺流程如图:
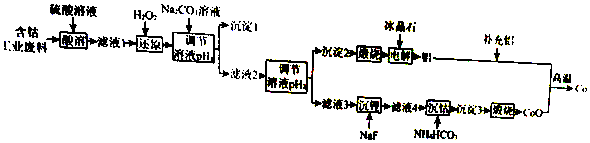
已知:
Ⅲ.离子浓度小于等于1.0×10-5mol•L-1时,认为该离子沉淀完全.
请回答下列问题:
(1)NaF的电子式为Na+[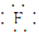 ]-.
]-.
(2)“沉淀1”的化学式为Fe(OH)3.“调节溶液pH2”的范围为4.7≤pH2<7.15.
(3)“还原”时发生反应的离子方程式为2CO3++H2O2=2CO2++O2↑2H+.“沉钴”时发生反应的离子方程式为CO2++2HCO3-=COCO3↓+CO2↑+H2O.
(4)制备Co时,“补充铝”的原因为原混合物中Al和Co的物质的量之比小于2:3.
(5)已知:l0-0.9≈0.13,则 A1(OH)3 的溶度积常数 Ksp=1.3×10-33.
(6)Li-SOCl2电池可用于心脏起搏器,该电池的总反应可表示为::4Li+2SOCl2═4LiCl+S+SO2,其正极反应式为2SOCl2+4e-=S+SO2+4Cl-.

已知:
| 含钴废料的成分 | |||||
| 成分 | Al | Li | Co2O3 | Fe2O3 | 其他不溶于强酸的杂质 |
| 质量分数/% | 10.5 | 0.35 | 65.6 | 9.6 | 13.95 |
| Ⅱ.实验中部分离子开始沉淀和沉淀完全的pH | |||
| 金属离子 | Fe3+ | Co2+ | Al3+ |
| 开始沉淀的pH | 1.9 | 7.15 | 3.4 |
| 沉淀完全的pH | 3.2 | 9.15 | 4.7 |
请回答下列问题:
(1)NaF的电子式为Na+[
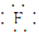 ]-.
]-.(2)“沉淀1”的化学式为Fe(OH)3.“调节溶液pH2”的范围为4.7≤pH2<7.15.
(3)“还原”时发生反应的离子方程式为2CO3++H2O2=2CO2++O2↑2H+.“沉钴”时发生反应的离子方程式为CO2++2HCO3-=COCO3↓+CO2↑+H2O.
(4)制备Co时,“补充铝”的原因为原混合物中Al和Co的物质的量之比小于2:3.
(5)已知:l0-0.9≈0.13,则 A1(OH)3 的溶度积常数 Ksp=1.3×10-33.
(6)Li-SOCl2电池可用于心脏起搏器,该电池的总反应可表示为::4Li+2SOCl2═4LiCl+S+SO2,其正极反应式为2SOCl2+4e-=S+SO2+4Cl-.
17.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 冷浓硝酸不能用铝制容器盛装 | |
| B. | 钠可从钴盐溶液中置换出钴单质 | |
| C. | 食盐中加入碘单质可以预防甲状腺肿大 | |
| D. | 光导纤维遇氢氧化钠溶液易“断路” |
4.化学与科技、生活密切相关.下列说法错误的是( )
| A. | 肥皂水、矿泉水及食醋三种溶液的pH依次减小 | |
| B. | 高铁车厢采用的铝合金材料强度大、质量轻,不与氧气反应 | |
| C. | 食品袋中放入盛有硅胶和铁粉的透气小袋,是为了防止食物受潮、氧化变质 | |
| D. | 采用“静电除尘”、“汽车尾气催化净化”等方法可减少“雾霾”的发生 |
14.下列化学工业所采取的措施中,能用勒夏特列原理解释的是( )
| A. | 合成氨工业:温度控制在500℃左右 | |
| B. | 接触法制硫酸:SO2在常压下催化氧化 | |
| C. | 侯氏制碱法:往母液中继续加入食盐和氨气 | |
| D. | 石油化工:将分馏得到的重油在高温下裂化 |
17.下列相关反应的离子方程式书写正确的是( )
| A. | 用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O | |
| B. | 稀硝酸中加入过量的铁粉:Fe+4H++NO3-=Fe2++NO↑+2H2O | |
| C. | Ba(HCO3)2溶液中加入过量的NaOH溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- | |
| D. | 用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ |
18.一氧化氮对空气说:一看到你我就会脸红,可逆反应2NO(g)+O2(g)?2NO2(g) 达到平衡状态时的标志是( )
| A. | 混合气体的密度不变 | |
| B. | 混合气体的颜色不再改变 | |
| C. | 正反应速率与逆反应速率相等均为零 | |
| D. | 反应物与生成物浓度相等 |