题目内容
17.下列相关反应的离子方程式书写正确的是( )| A. | 用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O | |
| B. | 稀硝酸中加入过量的铁粉:Fe+4H++NO3-=Fe2++NO↑+2H2O | |
| C. | Ba(HCO3)2溶液中加入过量的NaOH溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- | |
| D. | 用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ |
分析 A.小苏打为碳酸氢钠,离子方程式中碳酸氢根离子不能拆开;
B.离子方程式两边正电荷不相等;
C.氢氧化钠过量,反应生成碳酸钡沉淀、碳酸钠和水;
D.氢氧根离子与镁离子结合生成氢氧化镁沉淀.
解答 解:A.用小苏打治疗胃酸过多,碳酸氢根离子不能拆开,正确的离子方程式为:HCO3-+H+=CO2↑+H2O,故A错误;
B.稀硝酸中加入过量的铁粉,反应生成硝酸亚铁、NO气体和水,正确的离子方程式为:3Fe+8H++NO3-=3Fe2++2NO↑+4H2O,故B错误;
C.Ba(HCO3)2溶液中加入过量的NaOH溶液,反应的离子方程式为:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-,故C正确;
D.用惰性电极电解氯化镁溶液,反应生成氢气、氯气和氢氧化镁沉淀,正确的离子反应为:Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Mg(OH)2↓+H2↑+Cl2↑,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
相关题目
8.科学家研制出了一种新型的锂一空气电池,其工作原理如图所示.关于该电池的说法中不正确的是( )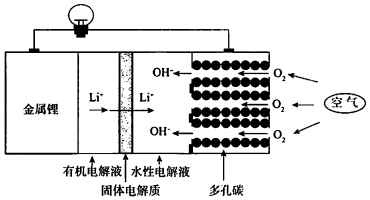

| A. | 回收水性电解液可制取锂 | |
| B. | 可将有机电解液改为水溶液 | |
| C. | 正极的电极反应式为O2+4e-+2H2O═4OH- | |
| D. | 电池总反应方程式为4Li+O2+2H2O═4LiOH |
9.SO2能使溴水褪色,说明SO2具有( )
| A. | 还原性 | B. | 漂白性 | C. | 酸性 | D. | 氧化性 |
5.反应:2A(g)+3B(g)?C(g)+4D(g),速率最快的是( )
| A. | v(A)=2.0mol•L-1•min-1 | B. | v(B)=4.0mol•L-1•min-1 | ||
| C. | v(C)=0.1mol•L-1•s-1 | D. | v(D)=0.3mol•L-1•s-1 |
12.下列有关原子结构和元素周期律表述正确的是( )
①ⅦA族元素是同周期中非金属性最强的元素
②原子序数为15的元素的最高化合价为+3
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族.
①ⅦA族元素是同周期中非金属性最强的元素
②原子序数为15的元素的最高化合价为+3
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族.
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ③④ |
2.锰酸锂(LiMn2O4)可作为锂离子电池的正极材料.工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如图1:
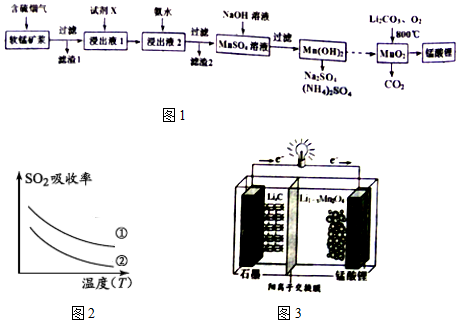
已知:①软锰矿主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质.
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
③部分氢氧化物沉淀相关的溶液pH如表一:
(1)已知:(图2)表二
表二
下列措施可提高SO2吸收率的是ad(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是H2O2(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是除去铁、铝元素.
(4)锰酸锂可充电电池(图3)的总反应式为:Li1-xMnO4+LixC$?_{放电}^{充电}$ LiMnO4+C(x<1)
①放电时,电池的正极反应式为Li1-xMnO4+xLi++xe-=LiMn2O4
②充电时,若转移1mole-,则石墨电极将增重7g.

已知:①软锰矿主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质.
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
③部分氢氧化物沉淀相关的溶液pH如表一:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
表二
| 实验序号 | SO2浓度(g•m-3) | 烟气流速(mL•min-1) |
| ① | 4.1 | 55 |
| ② | 4.1 | 96 |
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是H2O2(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是除去铁、铝元素.
(4)锰酸锂可充电电池(图3)的总反应式为:Li1-xMnO4+LixC$?_{放电}^{充电}$ LiMnO4+C(x<1)
①放电时,电池的正极反应式为Li1-xMnO4+xLi++xe-=LiMn2O4
②充电时,若转移1mole-,则石墨电极将增重7g.
9.下列有关物质的组成与结构的说法正确的是( )
| A. | 1 mol 庚烷分子中含共价键 23 NA | |
| B. | 所有烷烃分子中均存在极性键和非极性键 | |
| C. | C2H4、C2H4Br2、CH2Cl2均只能代表一种物质 | |
| D. | A、B 两种烃,它们含碳质量分数相同,则 A 和 B 最简式一定相同 |
6.氢气还原氧化铜:CuO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$ Cu+H2O,在该反应中( )
| A. | CuO作还原剂 | B. | 铜元素化合价降低 | ||
| C. | CuO作氧化剂 | D. | 铜元素被氧化 |
7.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 投入足量漂白粉后的溶液中:Fe2+、H+、Cl-、SO42- | |
| B. | 0.1mol/LFeCl3溶液中:Na+、Ba2+、NO3-、SCN- | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol/L的溶液中:NH4+、Ca2+、Cl、NO3- | |
| D. | 水电离的c(OH-)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32- |