题目内容
19.某老师批阅学生实验报告,下列哪些学生是以科学的态度记录实验数据的( )| A. | 甲学生用电子天平称取NaOH固体1.220g | |
| B. | 乙学生用广泛pH试纸测定溶液的酸碱性:pH=14.5 | |
| C. | 丙学生用碱式滴定管取25.0mL0.lmol/L的盐酸 | |
| D. | 丁学生用50mL 量筒量取46.70mL浓盐酸 |
分析 A.电子天平的读数应该读到0.001g;
B.pH试纸测定的读数为整数;
C.滴定管读数为0.01mL;
D.量筒精确对为0.1mL.
解答 解:A.甲学生用电子天平称取NaOH固体1.220g,故A正确;
B.广泛pH试纸的读数只能读出整数,且读数范围为0-14,无法读出14.5,故B错误;
C.滴定管最小读数为0.01mL,盐酸为酸,应该用酸式滴定管,故C错误;
D.量筒的最小读数为0.1ml,无法量取46.70mL的浓盐酸,故D错误;
故选:A.
点评 本题考查了计量仪器、pH试纸的使用方法,题目难度不大,注意掌握常见计量仪器的构造及使用方法,明确pH试纸的读数及正确使用方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.某同学设计了如下实验测量mg铜银合金样品中铜的质量分数:

下列说法中不正确的是( )

下列说法中不正确的是( )
| A. | 铜、银都能与硝酸反应,收集到的VL气体全为NO | |
| B. | 操作I、II、III分别为过滤、洗涤、干燥 | |
| C. | 利用气体体积VL及样品质量mg可计算铜的质量分数 | |
| D. | 久置的银器变黑、铜绿的形成都发生了氧化还原反应 |
10.化学与生产、生活、科技、环境等密切相关,下列说法正确的是( )
| A. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| B. | 铅笔芯的原材料为铅,所以儿童常咬铅笔头容易铅中毒 | |
| C. | 网络飞速发展,得益于光纤良好的导电性,光纤的主要成分是二氧化硅 | |
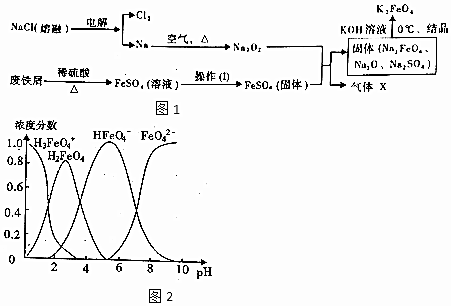
| D. | 用K2FeO4取代Cl2处理饮用水,不仅可杀菌消毒,同时还能沉降水中的悬浮物 |
7. X、Y、Z、W、R为原子序数依次增大的短周期元素.化合物甲由X、Z、W三种元素组成,常温下0.1mol/L甲溶液的pH=13.工业上常通过电解饱和WR溶液制得甲.Y的单质与由Y、Z组成的化合物之间的转化关系如图.下列叙述正确的是( )
X、Y、Z、W、R为原子序数依次增大的短周期元素.化合物甲由X、Z、W三种元素组成,常温下0.1mol/L甲溶液的pH=13.工业上常通过电解饱和WR溶液制得甲.Y的单质与由Y、Z组成的化合物之间的转化关系如图.下列叙述正确的是( )
 X、Y、Z、W、R为原子序数依次增大的短周期元素.化合物甲由X、Z、W三种元素组成,常温下0.1mol/L甲溶液的pH=13.工业上常通过电解饱和WR溶液制得甲.Y的单质与由Y、Z组成的化合物之间的转化关系如图.下列叙述正确的是( )
X、Y、Z、W、R为原子序数依次增大的短周期元素.化合物甲由X、Z、W三种元素组成,常温下0.1mol/L甲溶液的pH=13.工业上常通过电解饱和WR溶液制得甲.Y的单质与由Y、Z组成的化合物之间的转化关系如图.下列叙述正确的是( )| A. | 简单离子的半径:W>Z>R | |
| B. | XR与XRZ均为强酸 | |
| C. | 化合物W2Z2中既含离子键又含极性键 | |
| D. | 图中转化过程发生的反应均为化合反应 |
14. 在盛有稀 H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.关于该装置,下列说法正确的是( )
在盛有稀 H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.关于该装置,下列说法正确的是( )
 在盛有稀 H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.关于该装置,下列说法正确的是( )
在盛有稀 H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.关于该装置,下列说法正确的是( )| A. | 外电路中电流方向为:X→ →Y →Y | |
| B. | 若两电极分别为铁棒和碳棒,则 X 为碳棒,Y 为铁棒 | |
| C. | X 极上发生的是还原反应,Y 极上发生的是氧化反应 | |
| D. | 若两电极都是金属单质,则它们的活动性顺序为 X>Y |
4.阅读下列信息:
Ⅰ.表中①~⑥为短周期元素主要化合价及最简单氢化物沸点的数据:
A、B、C均为上表中的元素;
Ⅱ.A与B可形成化合物AB、AB2,二者可用于制备强酸甲;
Ⅲ.C与B可形成化合物CB2、CB3,二者可用于制备强酸乙.
请回答:
(1)该表中两种元素的氢化物所含电子数不同,这两种氢化物之间能发生反应,写出符合要求的化学方程式NH3+HCl=NH4Cl等(有多组符合,写出任意一个即可).
(2)元素②氢化物的沸点高于元素⑤氢化物的沸点,原因是水分子之间存在氢.
(3)甲、乙分别与氨反应生成丙、丁、戊三种盐.0.1mol/L的甲、乙、丙、丁、戊五种溶液,pH由小到大排列的顺序是(填写化学式)H2SO4、NH4HSO4、HNO3、(NH4)2SO4、NH4NO3.
(4)很稀的甲溶液与Zn反应,当反应的甲与Zn的物质的量之比为5:2时,还原产物可能为(填写化学式)NH4NO3、N2O.
Ⅰ.表中①~⑥为短周期元素主要化合价及最简单氢化物沸点的数据:
| 元素性质 | 元素编号 | |||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 氢化物沸点(℃) | -33.4 | 100 | 19.54 | -87.7 | -60.7 | -84.9 |
| 主要化合价 | +5 -3 | -2 | -1 | +5 -3 | +6 -2 | +7 -1 |
Ⅱ.A与B可形成化合物AB、AB2,二者可用于制备强酸甲;
Ⅲ.C与B可形成化合物CB2、CB3,二者可用于制备强酸乙.
请回答:
(1)该表中两种元素的氢化物所含电子数不同,这两种氢化物之间能发生反应,写出符合要求的化学方程式NH3+HCl=NH4Cl等(有多组符合,写出任意一个即可).
(2)元素②氢化物的沸点高于元素⑤氢化物的沸点,原因是水分子之间存在氢.
(3)甲、乙分别与氨反应生成丙、丁、戊三种盐.0.1mol/L的甲、乙、丙、丁、戊五种溶液,pH由小到大排列的顺序是(填写化学式)H2SO4、NH4HSO4、HNO3、(NH4)2SO4、NH4NO3.
(4)很稀的甲溶液与Zn反应,当反应的甲与Zn的物质的量之比为5:2时,还原产物可能为(填写化学式)NH4NO3、N2O.
8.科学家研制出了一种新型的锂一空气电池,其工作原理如图所示.关于该电池的说法中不正确的是( )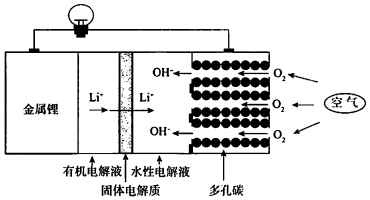

| A. | 回收水性电解液可制取锂 | |
| B. | 可将有机电解液改为水溶液 | |
| C. | 正极的电极反应式为O2+4e-+2H2O═4OH- | |
| D. | 电池总反应方程式为4Li+O2+2H2O═4LiOH |
9.SO2能使溴水褪色,说明SO2具有( )
| A. | 还原性 | B. | 漂白性 | C. | 酸性 | D. | 氧化性 |