题目内容
12.H2O2是重要的化学试剂,在实验室和生产实际中应用广泛.(1)写出H2O2在MnO2催化下分解的化学方式2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)在“海带提碘”的实验中,利用酸性H2O2得到碘单质的离子方程式是H2O2+2I-+2H+═2H2O+I2.
(3)实验室使用酸性KMnO4标准液测定溶液中H2O2的浓度.
①酸性KMnO4溶液应盛放在酸式(填“酸式”或“碱式”)滴定管中,判断到达滴定终点的现象是滴入一滴酸性KMnO4溶液后变紫色,30s不褪色.
②完成并配平离子方程式:□MnO4-+□H2O2+□H+═□Mn2++□O2↑+□H2O,在反应中H2O2作还原剂剂(填“氧化”或“还原”),每生成1mol O2,转移电子2mol.
分析 (1)过氧化氢在二氧化锰作催化剂的条件下生成水和氧气;
(2)H2O2与I-反应生成I2和H2O;
(3)①高锰酸钾溶液具有强氧化性,需要装在酸式滴定管中,滴定终点利用高锰酸钾溶液呈紫红色做指示剂指示到终点;
②依据氧化还原得失电子守恒配平.
解答 解:(1)过氧化氢在二氧化锰作催化剂的条件下生成水和氧气,双氧水分解的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑;故答案为:2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;(2)H2O2具有强氧化性能I-氧化为I2同时生成H2O,其反应的离子方程式为:H2O2+2I-+2H+═2H2O+I2;故答案为:H2O2+2I-+2H+═2H2O+I2;
(3)①高锰酸钾溶液具有强氧化性,需要装在酸式滴定管中,滴定终点利用高锰酸钾溶液呈紫红色做指示剂指示到终点;
故答案为:酸式; 滴入一滴酸性KMnO4溶液后变紫色,30s不褪色;
②氧化还原反应:MnO4-+H2O2+H+-Mn2++O2↑+H2O中,Mn的化合价从+7降低为+2价,降低了5价,O的化合价从-1价升高到了0价,两个氧原子一共升高了2价,所以Mn元素的前边系数是2,双氧水的前边系数是5,根据电荷守恒和原子守恒,得到反应为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,反应转移电子是10mol,若反应中生成1mol氧气,转移电子数是2mol电子,故答案为:2、5、6 2、5、8 H2O;还原剂;2.
点评 本题主要考查的是双氧水的性质,涉及双氧水的氧化性和还原性,氧化还原反应方程式的配平,得失电子的计算等,综合性较强,有一定难度.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案| A. | 1.2mol/(L•min) | B. | 6.0mol/(L•min) | C. | 0.6mol/(L•min) | D. | 0.4mol/(L•min) |
| A. | 将pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| B. | NH4HSO4溶液中滴加NaOH溶液至pH=7,则c(Na+)=2c(SO42-) | |
| C. | 0.1 mol•L-1CH3COOH溶液与0.1 mol•L-1CH3COONa等体积混合后pH<7,则c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | KNO3和CH3COONH4溶液pH均为7,两溶液中水的电离程度相同 |
实验(一) 碘含量的测定
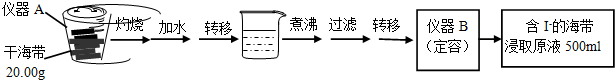
取0.0100mol•Lˉ1的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量.测的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
另制海带浸取原液,甲、乙两种实验方案如下:
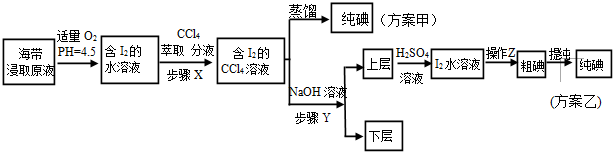
已知:3I2+6NaOH═5NaI+NaIO3+3H2O,请回答:
(1)实验(一) 中的仪器名称:仪器A坩埚,仪器 B500mL容量瓶.
(2)该次滴定终点时用去AgNO3溶液的体积为20.00mL,计算得海带中碘的百分含量为0.635%.
(3)①分液漏斗使用前须检漏.
②步骤X中,萃取后分液漏斗内观察到的现象是液体分为上下两层,下层呈紫红色.
③下列有关步骤Y的说法,正确的是AB.
A.应控制NaOH溶液的浓度和体积 B.将碘转化呈离子进入水层
C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替
(4)方案甲中采用蒸馏不合理,理由是碘单质易升华,会导致碘损失.
| A. | Na | B. | Al | C. | Fe | D. | Au |
| A. | 向NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 向饱和Na2CO3溶液中通入足量CO2:2Na++CO32-+CO2+H2O═2NaHCO3↓ | |
| C. | 向Ca(HCO3)2溶液中加入足量Ca(OH)2溶液:Ca2++HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向次氯酸溶液中滴加NaOH溶液:H++OH-═H2O |
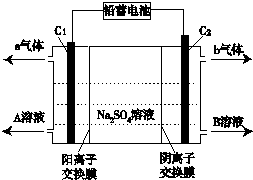
| A. | C1极电极与铅蓄电池的Pb电极相接,C2极与铅蓄电池的PbO2电极相接 | |
| B. | 当C1极产生标准状况下11.2 L气体时,铅蓄电池的负极增重64g | |
| C. | A溶液为氢氧化钠溶液,B溶液为硫酸 | |
| D. | 该电解反应的总方程式可以表示为:2Na2SO4+6H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑ |
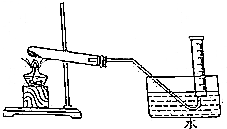 为验证MnO2在KClO3受热分解制O2的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:
为验证MnO2在KClO3受热分解制O2的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验: