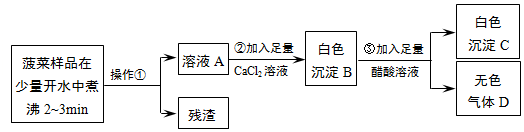
题目内容
16.已知X、Y、Z、W、R是元素周期表中前四周期的常见元素,相关信息如表所述:| 元素 | 相关信息 |
| X | 地壳中含量最多的元素 |
| Y | 元素的气态氢化物极易溶于水,水溶液遇酚酞变红 |
| Z | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物是自来水生产过程中常用的消毒剂 |
| W | 与Z同周期,第一电离能至第四电离能分别是:I1=578kJ•mol-1,I2=1817kJ•mol-1,I3=2745kJ•mol-1,I4=11575kJ•mol-1 |
| R | 有多种化合价,水溶液中其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 ,Z的基态原子的电子排布式为1s22s22p63s23p5.
,Z的基态原子的电子排布式为1s22s22p63s23p5.(2)用“>”、“<”或“=”填空:
| 简单离子半径 | 第一电离能 | 电负性 | 气态氢化物稳定性 |
| X<Y | X<Y | X>Z | H2X>YH3 |
①Y的气态氢化物的水溶液遇酚酞变红的原因NH3•H2O?NH4++OH-,
②W的最高价氧化物的水化物在水中发生电离H++AlO2-+H2O?Al(OH)3?Al3++3OH-.
分析 X为地壳中含量最多的元素,应为O元素,Y元素的气态氢化物极易溶于水,水溶液遇酚酞变红,为N元素,Z是海水中除氢、氧元素外含量最多的元素,其单质或化合物是自来水生产过程中常用的消毒剂,为Cl元素,W与Z同周期,第一电离能至第四电离能分别是:I1=578kJ•mol-1,I2=1817kJ•mol-1,I3=2745kJ•mol-1,I4=11575kJ•mol-1,根据W原子的第一电离能至第四电离可知,W原子的第四电离能剧增,则W表现+3价,所以W为Al元素,R有多种化合价,水溶液中其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色,为Fe元素,以此解答该题.
解答 解:由以上分析可知X为O、Y为N、Z为Cl、W为Al、R为Fe.
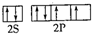
(1)R为Fe,位于周期表第四周期第VIII族,X为O,基态原子的价电子排布图为 ,Z为Cl,基态原子的电子排布式为1s22s22p63s23p5,
,Z为Cl,基态原子的电子排布式为1s22s22p63s23p5,
故答案为:第四周期第VIII族; ;1s22s22p63s23p5;
;1s22s22p63s23p5;
(2)X为O、Y为N,对应离子具有相同的核外电子排布,离子半径O<N,N的最外层为半充满结构,较为稳定,第一电离能较大,大于O,O的电负性大于Cl,非金属性O>N,元素的非金属性越强,对应的氢化物越稳定,
故答案为:<;<;>;>;
(3)①氨气与水反应生成NH3•H2O,可发生电离,生成OH-,溶液呈碱性,离子方程式为NH3•H2O?NH4++OH-,故答案为:NH3•H2O?NH4++OH-;
②氢氧化铝为两性氢氧化物,电离方程式为H++AlO2-+H2O?Al(OH)3?Al3++3OH-,故答案为:H++AlO2-+H2O?Al(OH)3?Al3++3OH-.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,根据题干信息正确推断各元素名称为解答关键,侧重于考查学生的分析能力和对基础知识的综合应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | l mol羟基含有的电子数为9NA | |
| B. | 常温下,l mol乙烯和乙硼烷(B2H6)的混合气体所含的电子数为16NA | |
| C. | l mol苯乙烯中含有的碳碳双键数为4NA | |
| D. | 26 g乙炔和苯蒸气的混合气体中所含的碳原子数为2NA |
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| B | 向稀硝酸中加入少量铁粉 | 有气泡产生 | 说明Fe置换出硝酸中的氢,生成了氢气 |
| C | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色胶状物质 | H2CO3的酸性比H2SiO3的酸性强 |
| D | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | NaHCO3为难溶物 |
| A. | A | B. | B | C. | C | D. | D |
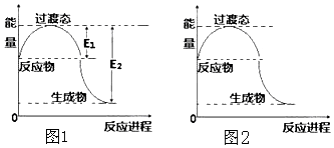 回答下列问题:
回答下列问题:(1)2molCH4(g)和4mol O2(g)反应生成CO2(g)和H2O(g)过程中的能量变化如图1所示.已知E1=134KJ,E2=368KJ.则热化学方程式为2CH4(g)+4O2(g)=2CO2(g)+4H2O(g)△H=-234 kJ•mol-1生成18g H2O(l)放出或吸收的能量(范围)>58.5KJ
请在图2中画出加入催化剂后,反应过程中的能量变化曲线.
(2)在一定条件下,已知下列反应的热化学反应式:
C(石墨,s)+O2(g)=CO2(g)△H1; 2H2(g)+O2(g)=2H2O(l)△H2
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3
由C(石墨,s)和气态H2反应合成气态1mol C2H2的热化学方程式2C (s,石墨)+H2(g)=C2H2(g))△H=2△H1+$\frac{1}{2}$△H2-$\frac{1}{2}$△H3;
(3)工业上可通过CO(C≡O)和H2化合制得CH3OH(气态),各键能数据如表所示
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能(kJ/mol) | 348 | 413 | 436 | 358 | 1072 | 463 |
| A. | 常温常压下,16 g O3中含有的原子数为NA | |
| B. | 标准状况下,22.4 L H2O中含有的分子数为NA | |
| C. | 1 mol Na在空气中完全燃烧转移的电子数为2NA | |
| D. | 1 L 1 mol•L-1 CaCl2溶液中含有的氯离子数为NA |