题目内容
1.某同学对“菠菜中富含可溶性草酸盐和碳酸盐,与豆腐同食会引起结石”的说法产生了兴趣.探究一 菠菜里是否含有可溶性草酸盐和碳酸盐?
【查阅资料】
①可溶的草酸盐、碳酸盐能与CaCl2溶液反应生成难溶于水的草酸钙(CaC2O4)、碳酸钙.
②醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐.
【实验流程】
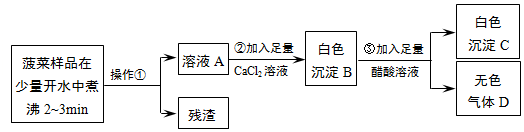
根据流程回答问题:(1)操作①是过滤.
( 2)加入足量CaCl2溶液的目的是将溶液中的草酸根和碳酸根完全沉淀出来.
(3)已知气体D能使澄清石灰水变浑浊,步骤③的化学反应方程式为CaCO3+2HAc=Ca(Ac)2+H2O+CO2↑.
【实验结论】菠菜里含有可溶性草酸盐和碳酸盐.
探究二 人体结石的主要成分是草酸钙,草酸钙高温分解的产物是什么?
【查阅资料】
①草酸钙高温完全分解得到两种气态氧化物和一种固态氧化物.
②12.8g的草酸钙分解过程中温度与剩余固体的质量关系如下图所示.
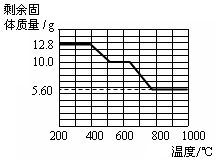
【实验分析】(4)草酸钙高温完全分解的化学方程式为CaC2O4 $\frac{\underline{\;高温\;}}{\;}$CaO+CO↑+CO2↑.
(5)通过图数据分析,700℃时剩余固体的成分是碳酸钙和氧化钙的混合物.
分析 探究一:菠菜样品在开水中煮沸2-3分钟,过滤得到溶液A,加入足量氯化钙沉淀碳酸根离子和草酸根离子,得到白色沉淀B为碳酸钙和草酸钙,醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐,加入足量醋酸过滤得到白色沉淀为草酸钙和二氧化碳气体,
(1)分离固态和可溶性物质的一种常用方法是过滤;
(2)可溶的草酸盐、碳酸盐能与CaCl2溶液反应生成难溶于水的草酸钙(CaC2O4)、碳酸钙,所以可以加入氯化钙来是草酸根和碳酸根沉淀出来;
(3)根据醋酸(化学式用HAc表示)不与草酸钙反应,但能与碳酸钙反应生成可溶性盐可以写出该反应的化学方程式;
探究二(4)解题依据是利用质量守恒定律的实质:反应前后元素的种类不变,并结合题给条件来书写化学方程式;
(5)根据图表可以分析出在草酸钙分解的过程中存在着两个过程:一个是产生一氧化碳的过程,另一个是产生二氧化碳的过程.
解答 解:探究一:(1)分离固态和可溶性物质的一种常用方法------过滤,本题操作①之后是残渣和溶液,故判断该操作为过滤,
故答案为:过滤;
(2)由于我们探究的是菠菜中的两种盐,由题给条件可知,有一种可溶,一种不可溶,所以我们想办法将溶液中的草酸根和碳酸根完全沉淀出来,而氯化钙可以把它们都沉淀出来,然后根据“醋酸(化学式用HAc表示)不与草酸钙反应,但能与碳酸钙反应生成可溶性盐”这一结论来完成它们的判定,加入足量CaCl2溶液的目的是:将溶液中的草酸根和碳酸根完全沉淀出来,
故答案为:将溶液中的草酸根和碳酸根完全沉淀出来;
(3)根据题给条件,反应生成了是澄清石灰水变浑浊的气体,再结合题给信息可以判断发生的反应为:CaCO3+2HAc=Ca(Ac)2+H2O+CO2↑,
故答案为:CaCO3+2HAc=Ca(Ac)2+H2O+CO2↑;
探究二:(4)根据题给条件及质量守恒定律可知,草酸钙中含有钙元素、碳元素、和氧元素,那么生成的气态氧化物就是一氧化碳和二氧化碳,从而可以写出该化学方程式为:CaC2O4 $\frac{\underline{\;高温\;}}{\;}$CaO+CO↑+CO2↑,
故答案为:CaC2O4 $\frac{\underline{\;高温\;}}{\;}$CaO+CO↑+CO2↑;
(5)从图表中可以分析出,草酸钙的分解分为两个过程,再结合题给条件可知第一个过程中生成的应该是一氧化碳和碳酸钙,然后碳酸钙分解产生二氧化碳,在700℃时正处在碳酸钙分解的过程中,故剩余的固体成分为碳酸钙和氧化钙的混合物,
故答案为:碳酸钙和氧化钙的混合物.
点评 本题主要是考查学生综合运用知识来解决问题的能力,解题时要注意题给的信息即“查阅资料”部分,这对解题有较大的帮助,往往有些答案就来自于此,题目难度中等.

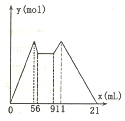 如图是向MgCl2、A1C13混合溶液中先滴加试剂A,然后改滴试剂B,所得沉淀的物质
如图是向MgCl2、A1C13混合溶液中先滴加试剂A,然后改滴试剂B,所得沉淀的物质的量y(mol)与试剂体积V(mL)间的关系,以下结论不正确的是( )
| A. | 原混合液中,c(A13+):c(Mg2+):c(C1)=1:1:5 | |
| B. | 若A和B为一元强碱和一元强酸,则滴加7.5mL剂A后改滴试剂B | |
| C. | 若A是NaOH,B是盐酸,则c(NaOH):c(HC1)=2:1 | |
| D. | 从6到9,相应离子反应方程式H++OH-═H2O |
| 元素 | 相关信息 |
| X | 地壳中含量最多的元素 |
| Y | 元素的气态氢化物极易溶于水,水溶液遇酚酞变红 |
| Z | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物是自来水生产过程中常用的消毒剂 |
| W | 与Z同周期,第一电离能至第四电离能分别是:I1=578kJ•mol-1,I2=1817kJ•mol-1,I3=2745kJ•mol-1,I4=11575kJ•mol-1 |
| R | 有多种化合价,水溶液中其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 ,Z的基态原子的电子排布式为1s22s22p63s23p5.
,Z的基态原子的电子排布式为1s22s22p63s23p5.(2)用“>”、“<”或“=”填空:
| 简单离子半径 | 第一电离能 | 电负性 | 气态氢化物稳定性 |
| X<Y | X<Y | X>Z | H2X>YH3 |
①Y的气态氢化物的水溶液遇酚酞变红的原因NH3•H2O?NH4++OH-,
②W的最高价氧化物的水化物在水中发生电离H++AlO2-+H2O?Al(OH)3?Al3++3OH-.
| A. | 氨气通入稀硫酸 NH3+H+═NH4+ | |
| B. | 稀烧碱溶液和氯化铵溶液混合 NH4++OH-═NH3•H2O | |
| C. | 碳酸氢铵和足量浓烧碱溶液混合加热 NH4++OH-═NH3↑+H2O | |
| D. | Cl2和水反应 Cl2+H2O═H++Cl-+HClO |
| A. | 混合气体的压强不再变化 | B. | 混合气体的密度不再变化 | ||
| C. | 混合气体的颜色不再变化 | D. | 混合气体中c(H2):c(I2):c(HI)=1:1:2 |
| A. | SO2→SO3 | B. | Na2SO3→SO2 | C. | SO2→S | D. | H2S→S |
 )有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是
)有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是 、
、 、
、 任意2种(写出任意2种的结构简式)
任意2种(写出任意2种的结构简式)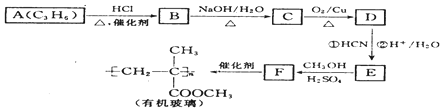
 $→_{②H+/H_{2}O}^{①HCN}$
$→_{②H+/H_{2}O}^{①HCN}$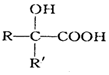 (注:R′可以是H原子)
(注:R′可以是H原子) 是一种生物可降解材料,请参考上述信息设计由乙醇制备聚乳酸的合成路线
是一种生物可降解材料,请参考上述信息设计由乙醇制备聚乳酸的合成路线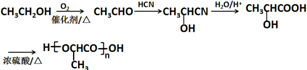 .合成路线流程图图示例如下:X$→_{反应条件}^{反应物}$Y$→_{反应条件}^{反应物}$Z…目标产物.
.合成路线流程图图示例如下:X$→_{反应条件}^{反应物}$Y$→_{反应条件}^{反应物}$Z…目标产物.