题目内容
如图为阳离子交换膜法电解饱和食盐水原理示意图.下列说法不正确的是( )


| A、完全电解后加适量盐酸可以恢复到电解前的浓度 |
| B、从B中加入含少量NaOH的水溶液以增强导电性 |
| C、标准状况下每生成22.4 L Cl2,使产生2 mol NaOH |
| D、从E口逸出的气体是H2 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A、电解饱和氯化钠溶液放出氢气和氯气,溶液为氢氧化钠溶液,恢复原溶液浓度溶液中减少什么,就需要加入什么;
B、溶液中离子浓度越大,导电性越强,D极生成氢氧化钠;
C、根据电极方程式来回答;
D、根据钠离子的移动方向确定电解池的阴阳极.
B、溶液中离子浓度越大,导电性越强,D极生成氢氧化钠;
C、根据电极方程式来回答;
D、根据钠离子的移动方向确定电解池的阴阳极.
解答:
解:解:A、电解原理方程式2NaCl+2H2O
2NaOH+Cl2↑+H2↑,适量HCl可以恢复到电解前的浓度,加入盐酸会多加入水使溶液变稀,故A错误;
B、阴极D极产生大量的氢氧化钠,为了增强导电性,可以从B口加入含少量NaOH的水溶液,故B正确;
C、电解原理方程式2NaCl+2H2O
2NaOH+Cl2↑+H2↑,标准状况下每生成22.4L即1molC12,便产生2molNaOH,故C正确;
D、在电解池中,钠离子移向阴极,所以D极是阴极,该极除了产生氢氧化钠以外还会产生氢气,故从E口逸出的气体是H2,故D正确;
故选A.
| ||
B、阴极D极产生大量的氢氧化钠,为了增强导电性,可以从B口加入含少量NaOH的水溶液,故B正确;
C、电解原理方程式2NaCl+2H2O
| ||
D、在电解池中,钠离子移向阴极,所以D极是阴极,该极除了产生氢氧化钠以外还会产生氢气,故从E口逸出的气体是H2,故D正确;
故选A.
点评:本题考查学生电解池的工作原理知识,注意把握电极的判断以及电解方程式的书写方法,题目难度中等.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案
相关题目
下列说法正确的是( )
| A、提纯鸡蛋白中的蛋白质时,可向鸡蛋清溶液中加入浓硫酸铵溶液,然后将所得沉淀滤出,经洗涤即得到较纯净的蛋白质 |
| B、油脂都不能使溴的四氯化碳溶液褪色 |
| C、石油分馏、煤的干馏均为物理变化 |
| D、纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 |
对于可逆反应N2(g)+3H2(g)
2NH3(g),在不同条件下的化学全品高考网“反应速率如下,其中表示反应速率最快的是( )
| 催化剂 |
| 高温高压 |
| A、υ(H2)=0.3mol/(L?min) |
| B、υ(N2)=0.2mol/(L?min) |
| C、υ(NH3)=0.25mol/(L?min) |
| D、υ(H2)=0.4mol/(L?min) |
下列装置能形成原电池的是( )
A、 |
B、 |
C、 |
D、 |
X、Y、Z、W为原子序数依次增大的短周期元素.其形成的小分子化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构.下列说法正确的是( )
| A、X、Y、Z、W的原子半径的大小关系为:W>Y>Z>X |
| B、在化合物Y2X2、Z2X4、X2W2中,分子所含的共用电子对数相等 |
| C、与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键 |
| D、X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的有机物 |
短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法正确的是( )
| X | Y | ||
| Z | W | Q |
| A、W得电子能力比Q强 |
| B、由Z与Y组成的物质在熔融时能导电 |
| C、钠与Y可能形成Na2Y2化合物 |
| D、X有多种同素异形体,而Y不存在同素异形体 |
下列各组物质中,互为同素异形体的是( )
| A、氕和氘 | B、水和重水 |
| C、纯碱和烧碱 | D、石墨和金刚石 |
下列图示与对应的叙述相符的是( )
A、 温度T1>T2,SO2与O2反应过程中的能量变化 |
B、 表示0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/LCH3COOH溶液所得到的滴定曲线 |
C、 表示Zn、Cu和稀硫酸构成的原电池在工作过程中电流强度的变化,T时加入了H2O2 |
D、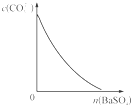 表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 |
