题目内容
短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法正确的是( )
| X | Y | ||
| Z | W | Q |
| A、W得电子能力比Q强 |
| B、由Z与Y组成的物质在熔融时能导电 |
| C、钠与Y可能形成Na2Y2化合物 |
| D、X有多种同素异形体,而Y不存在同素异形体 |
考点:元素周期律和元素周期表的综合应用
专题:
分析:这几种元素都是短周期元素,根据元素在周期表中的位置知,X、Y是短周期元素,Z、W、Q是第三周期元素,X元素的原子内层电子数是最外层电子数的一半,X能层电子数是2,其最外层电子数是4,则X是C元素,Y是O元素、Z是Si元素、W是S元素、Q是Cl元素,
A.元素的非金属性越强,其得电子能力越强;
B.由Z与Y组成的物质是二氧化硅,属于原子晶体;
C.Na和O元素可以形成过氧化钠;
D.氧元素形成的单质有同素异形体.
A.元素的非金属性越强,其得电子能力越强;
B.由Z与Y组成的物质是二氧化硅,属于原子晶体;
C.Na和O元素可以形成过氧化钠;
D.氧元素形成的单质有同素异形体.
解答:
解:这几种元素都是短周期元素,根据元素在周期表中的位置知,X、Y是短周期元素,Z、W、Q是第三周期元素,X元素的原子内层电子数是最外层电子数的一半,X能层电子数是2,其最外层电子数是4,则X是C元素,Y是O元素、Z是Si元素、W是S元素、Q是Cl元素,
A.元素的非金属性越强,其得电子能力越强,非金属性Q>W,所以Q得电子能力大于W,故A错误;
B.由Z与Y组成的物质是二氧化硅,属于原子晶体,其熔融状态没有自由移动的离子,所以不导电,故B错误;
C.Na和O元素可以形成Na2O2,故C正确;
D.氧元素形成的单质同素异形体为氧气和臭氧,故D错误;
故选C.
A.元素的非金属性越强,其得电子能力越强,非金属性Q>W,所以Q得电子能力大于W,故A错误;
B.由Z与Y组成的物质是二氧化硅,属于原子晶体,其熔融状态没有自由移动的离子,所以不导电,故B错误;
C.Na和O元素可以形成Na2O2,故C正确;
D.氧元素形成的单质同素异形体为氧气和臭氧,故D错误;
故选C.
点评:本题考查元素周期表和元素周期律综合应用,正确判断X为解题关键,熟练掌握并灵活运用基本概念、物质结构、元素周期律等知识点,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
甲、乙两溶液中,分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-6种离子中的3种,已知甲溶液呈蓝色,则乙溶液中大量存在的离子是( )
| A、CO32-、OH-、Cl- |
| B、Cu2+、H+、Cl- |
| C、K+、H+、Cl- |
| D、K+、OH-、CO32- |
如图为阳离子交换膜法电解饱和食盐水原理示意图.下列说法不正确的是( )


| A、完全电解后加适量盐酸可以恢复到电解前的浓度 |
| B、从B中加入含少量NaOH的水溶液以增强导电性 |
| C、标准状况下每生成22.4 L Cl2,使产生2 mol NaOH |
| D、从E口逸出的气体是H2 |
下列说法正确的是( )
| A、非金属元素组成的化合物中只可能含有共价键 |
| B、ⅦA族元素气态氢化物的热稳定性和还原性从上到下依次减弱 |
| C、第三周期非金属元素最高价含氧酸的酸性从左到右依次增强 |
| D、元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
NA代表阿伏加德罗常数,下列说法不正确的是( )
| A、标准状况下,11.2L氯仿(CHCl3)中含有C-Cl键的数目为1.5NA |
| B、常温常压下,15g甲基(-CH3)所含的电子数为9NA |
| C、同温同压下,1LNO和1LO2充分混合体积小于1.5L |
| D、pH=l的醋酸溶液100mL中氢离子数为0.01 NA |
设NA为何伏加德罗常数的值,下列叙述正确的是( )
| A、1mol甲醇中含有C-H键数目为4NA |
| B、室温下,PH=13的NaOH溶液中含有OH-的数目为0.1NA |
| C、标准状况下,2.24L已烷含有的分子数目为0.1NA |
| D、常温常压下,46gNO2和N2O4的混合气体中含有的原子数为3NA |
设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A、0.1mol Fe 与0.1mol Cl2充分反应,转移的电子数为0.3 NA |
| B、常温常压下,1mol的氦气和氢气混合气,含有的核外电子数为2NA |
| C、25℃时,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2 NA |
| D、标准状况下,2.24L CCl4和CH2O的混合物中含有NA个碳原子 |
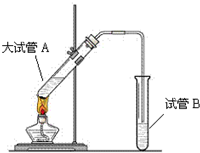 “酒是陈年的香”,是因为乙醇被少量氧气氧化,氧化产物与乙醇反应生成有香味的物质,实验室可以模拟后一过程.
“酒是陈年的香”,是因为乙醇被少量氧气氧化,氧化产物与乙醇反应生成有香味的物质,实验室可以模拟后一过程.