题目内容
15.下列各组元素中,非金属性依次增大的是( )| A. | I、Br、Cl | B. | Al、P、Si | C. | O、S、Na | D. | N、C、B |
分析 同周期随原子序数增大,非金属性增强;
同一主族,随着原子序数的递增,非金属性减弱,据此判断.
解答 解:A.I、Br、Cl原子序数依次减小,非金属性依次增大,故A正确;
B.P与Si原子序数依次减小,故非金属性依次减弱,故B错误;
C.Na的金属性最强,故C错误;
D.B、C、N的原子序数依次增大,非金属性增强,故D错误,故选A.
点评 本题考查同周期、同主族元素性质递变规律,难度不大,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
6. 某学生欲用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.直到因加入一滴标准液而使溶液由红色变为无色并在30s内不恢复.
( 2)下列说法中正确的有A
A.滴定管主要用来精确地放出一定体积的溶液
B.碱性溶液和强氧化性溶液应该选择碱式滴定管
C.滴定管润洗的方法是从上口将所要盛装的溶液装满,在从下口将液体放入预置的烧杯中
D.排出碱式滴定管尖嘴部分气泡的方法是打开活塞快速放液以赶走气泡
E.本实验中待测的氢氧化钠溶液需要用量筒来量取
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
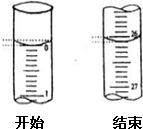
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处.
(5)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=0.1044mol/L.
 某学生欲用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.直到因加入一滴标准液而使溶液由红色变为无色并在30s内不恢复.
( 2)下列说法中正确的有A
A.滴定管主要用来精确地放出一定体积的溶液
B.碱性溶液和强氧化性溶液应该选择碱式滴定管
C.滴定管润洗的方法是从上口将所要盛装的溶液装满,在从下口将液体放入预置的烧杯中
D.排出碱式滴定管尖嘴部分气泡的方法是打开活塞快速放液以赶走气泡
E.本实验中待测的氢氧化钠溶液需要用量筒来量取
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处.
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL)] | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | |||
| 第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
3.物质的结构决定物质的性质.请回答下列涉及物质结构和性质的问题:
(1)第二周期中,元素的第一电离能处于B与N之间的元素有3种.
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为3d84s2.
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到.乙烯酮分子中碳原子杂化轨道类型是sp2和sp,1mol(C2H5O)3P=O分子中含有的σ键的数目为25NA.
(4)已知固态NH3、H2O、HF的氢键键能和结构如图1:

解释H2O、HF、NH3沸点依次降低的原因单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n,.
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能.碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有4个,与碳原子等距离最近的碳原子有12个.已知碳化硅晶胞边长为apm,则晶胞图2中1号硅原子和2号碳原子之间的距离为$\frac{\sqrt{11}a}{4}$pm,碳化硅的密度为$\frac{1.6×1{0}^{32}}{{a}^{3}×{N}_{A}}$g/cm3.
(1)第二周期中,元素的第一电离能处于B与N之间的元素有3种.
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为3d84s2.
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到.乙烯酮分子中碳原子杂化轨道类型是sp2和sp,1mol(C2H5O)3P=O分子中含有的σ键的数目为25NA.
(4)已知固态NH3、H2O、HF的氢键键能和结构如图1:
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

解释H2O、HF、NH3沸点依次降低的原因单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n,.
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能.碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有4个,与碳原子等距离最近的碳原子有12个.已知碳化硅晶胞边长为apm,则晶胞图2中1号硅原子和2号碳原子之间的距离为$\frac{\sqrt{11}a}{4}$pm,碳化硅的密度为$\frac{1.6×1{0}^{32}}{{a}^{3}×{N}_{A}}$g/cm3.
20.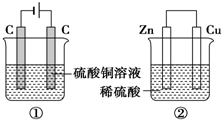 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )
 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 电极反应式:①中阴极:Cu2++2e-═Cu②中正极:2H++2e-═H2↑ | |
| D. | 反应完成后溶液PH:①<7,②>7 |
5.结合元素周期表和周期律的相关知识,判断下列说法正确的是( )
| A. | 短周期主族元素原子的最外层电子数都等于元素的最高化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | 同周期第ⅡA族与第ⅢA族的元素原子序数之差不一定为1 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
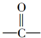 与HCN反应引入:
与HCN反应引入: $→_{一定条件}^{HCN}$
$→_{一定条件}^{HCN}$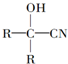
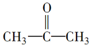 $→_{一定条件①}^{HCN}$A$\underset{\stackrel{{H}_{2}O,{H}^{+}}{→}}{②}$B$→_{③}^{浓H_{2}SO_{4},△}$C$→_{催化剂④}^{聚合}$D
$→_{一定条件①}^{HCN}$A$\underset{\stackrel{{H}_{2}O,{H}^{+}}{→}}{②}$B$→_{③}^{浓H_{2}SO_{4},△}$C$→_{催化剂④}^{聚合}$D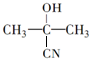 ,D
,D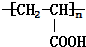 .
.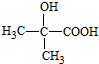 $→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.
$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.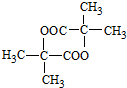 .
.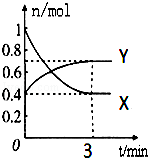 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.