题目内容
5.结合元素周期表和周期律的相关知识,判断下列说法正确的是( )| A. | 短周期主族元素原子的最外层电子数都等于元素的最高化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | 同周期第ⅡA族与第ⅢA族的元素原子序数之差不一定为1 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
分析 A.氧元素、氟元素没有最高正化合价;
B.能量高的电子在离核较远的区域内运动;
C.长周期元素中ⅡA族、ⅢA族之间相隔10列;
D.过渡元素为长周期中第3列~12列元素.
解答 解:A.氧元素、氟元素没有最高正化合价,氧元素、氟元素除外,主族元素原子的最外层电子数等于元素的最高化合价,故A错误;
B.离核较近的区域能量较低,多电子原子中,能量高的电子在离核较远的区域内运动,故B错误;
C.短周期中,同周期第ⅡA族与第ⅢA族的元素原子序数之差为1,但长周期元素中ⅡA族、ⅢA族之间相隔10列,故同周期第ⅡA族与第ⅢA族的元素原子序数之差不一定为1,故C正确;
D.过渡元素为长周期中第3列~12列元素,故D错误.
故选:C.
点评 本题考查元素周期表与元素周期律、核外电子排布等,难度不大,注意元素化合价与族序数的关系,注意副族元素与O、F元素特殊性.

练习册系列答案
相关题目
15.下列各组元素中,非金属性依次增大的是( )
| A. | I、Br、Cl | B. | Al、P、Si | C. | O、S、Na | D. | N、C、B |
16.铅蓄电池在现代生活中具有广泛的应用.已知铅蓄电池的电解质溶液为H2SO4溶液,其充电、放电按下式进行2PbSO4+2H2O$?_{放电}^{充电}$Pb+PbO2+2H2SO4,有关该电池的说法正确的是( )
| A. | 放电时溶液中的H+向负极移动 | |
| B. | 在放电时,正极发生的反应是 Pb(s)+SO42-(aq)=PbSO4(s)+2e- | |
| C. | 在放电时,该电池的负极材料是铅板 | |
| D. | 放电时负极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
13.下列说法正确的是( )
| A. | 常温下,由水电离出的c(H+)=10-12mol/L,则溶液pH一定为12 | |
| B. | 已知H2C2O4是弱酸,其电离方程式为:H2C2O4?2H++C2O42- | |
| C. | 常温下,pH=10的氨水溶液中,由水电离出的c(H+)=10-10mol/L | |
| D. | 工业合成氨温度控制在500℃,目的是为了提高产率 |
20.下列实验能达到实验目的且符合安全要求的是( )
| A. |  利用排空气法收集CO2 | B. |  收集氧气 | ||
| C. |  制备并检验氢气的可燃性 | D. |  氨水溶于水 |
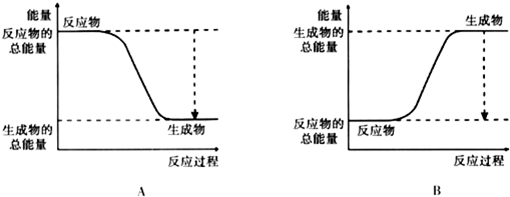
10.从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.
(1)为了加快反应速率,不可以采取的措施有ABC (填序号,下同).
A.使用催化剂 B.提高氧气的浓度
C.提高反应的温度 D.降低反应的温度
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是A
(3)从断键和成键的角度分析上述反应中能量的变化.已知化学键的键能如表:
由此计算2mol H2在氧气中燃烧生成气态水放出的热量484kJ.
(1)为了加快反应速率,不可以采取的措施有ABC (填序号,下同).
A.使用催化剂 B.提高氧气的浓度
C.提高反应的温度 D.降低反应的温度
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是A

(3)从断键和成键的角度分析上述反应中能量的变化.已知化学键的键能如表:
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
14.互为同分异构体的物质不可能具有( )
| A. | 相同的式量 | B. | 相同的结构 | C. | 相同的通式 | D. | 相同的分子式 |
15. 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格).
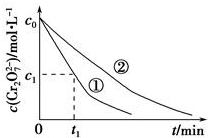
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示.
(2)上述反应中参加反应的Cr2O72-与草酸的物质的量之比为1:3.
(3)实验①和②的结果表明溶液pH对该反应的速率有影响;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三.
假设一:Fe2+起催化作用:
假设二:Al3+起催化作用;
假设三:SO42-起催化作用;…
(5)请你设计实验验证上述假设一,完成下表中内容.
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格).
| 验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | 20 |
(2)上述反应中参加反应的Cr2O72-与草酸的物质的量之比为1:3.
(3)实验①和②的结果表明溶液pH对该反应的速率有影响;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三.
假设一:Fe2+起催化作用:
假设二:Al3+起催化作用;
假设三:SO42-起催化作用;…
(5)请你设计实验验证上述假设一,完成下表中内容.
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
 .
.