题目内容
20.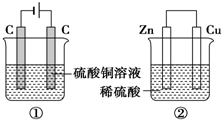 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 电极反应式:①中阴极:Cu2++2e-═Cu②中正极:2H++2e-═H2↑ | |
| D. | 反应完成后溶液PH:①<7,②>7 |
分析 根据电池的工作原理写出电极反应,在两极上,得失电子数相等,可以根据电子守恒来进行相关的计算.
解答 解:A、①是电解池,电极反应为:阳极:4OH-→O2↑+2H2O+4e-,阴极:Cu2++2e-→Cu,②是原电池,正极反应:2H++2e-→H2,负极反应:Zn+2e-→Zn2+,液体体积均为200mL,浓度均为0.5mol/L,所以硫酸铜、硫酸的物质的量均为0.1mol,当有0.02mol的电子通过时,①产生的气体是氧气,为0.005mol,②中0.01mol氢气放出,所以①<②,故A错误;
B、①中阴极反应:Cu2++2e-→Cu,阴极质量增加,②中正极反应:2H++2e-→H2,正极质量不变,故B错误;
C、电极反应式:①中阴极:Cu2++2e-→Cu,2H++2e-→H2↑,②中正极反应:2H++2e-→H2↑,故C错误;
D、溶液的pH变化:①中消耗氢氧根,所以碱性减弱pH减小,②中消耗氢离子,所以酸性减弱pH增大,故D正确.
故选D.
点评 本题考查学生原电池和电解池的工作原理以及电极反应的书写知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
9.下列说法不正确的是( )
| A. | 0.2mol/L的NaHCO3溶液中:[Na+]>[HCO3-]>[OH-]>[H+] | |
| B. | 在0.1mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) | |
| C. | 向氨水中逐滴加入盐酸至溶液的pH=7,则混合液中:[NH4+]=[Cl-] | |
| D. | pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 |
15.下列各组元素中,非金属性依次增大的是( )
| A. | I、Br、Cl | B. | Al、P、Si | C. | O、S、Na | D. | N、C、B |
12.我国稀土资源丰富.下列有关稀土元素${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的说法正确的是( )
| A. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm互为同位素 | |
| B. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的质量数相同 | |
| C. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm是同一种核素 | |
| D. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm是不同元素 |
10.从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.
(1)为了加快反应速率,不可以采取的措施有ABC (填序号,下同).
A.使用催化剂 B.提高氧气的浓度
C.提高反应的温度 D.降低反应的温度
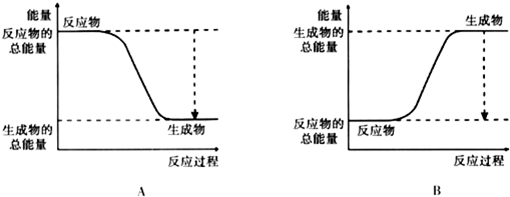
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是A
(3)从断键和成键的角度分析上述反应中能量的变化.已知化学键的键能如表:
由此计算2mol H2在氧气中燃烧生成气态水放出的热量484kJ.
(1)为了加快反应速率,不可以采取的措施有ABC (填序号,下同).
A.使用催化剂 B.提高氧气的浓度
C.提高反应的温度 D.降低反应的温度
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是A

(3)从断键和成键的角度分析上述反应中能量的变化.已知化学键的键能如表:
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |

 )和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式:
)和双氧水为原料生产过氧化苯甲酰,写出合成过氧化苯甲酰的化学反应方程式: ,该反应属于取代反应.
,该反应属于取代反应. .苯甲酸的同分异构体中,属于酯类的有
.苯甲酸的同分异构体中,属于酯类的有 ,属于酚类的有3.(写结构简式)
,属于酚类的有3.(写结构简式)
