题目内容
常温下有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的HCl溶液;③pH=11的氨水;④pH=11的NaOH溶液.下列说法正确的是( )
| A、①与②中c(H+)相同 |
| B、①与④混合,溶液中c(CH3COO-)=c(Na+) |
| C、②和③混合,所得混合溶液的pH等于7 |
| D、③与④分别用等浓度的盐酸中和,消耗盐酸的体积相同 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A、pH=3的CH3COOH溶液和pH=3的HCl溶液中c(H+)=10-3mol/L;
B、pH=3的CH3COOH溶液中酸部分电离,酸的浓度大于0.001mol/L,pH=11的NaOH溶液中氢氧化钠完全电离,碱的浓度为0.001mol/L;
C、pH=11的氨水与pH=3的盐酸溶液等体积混合,氨水平衡状态下的氢氧根离子浓度和盐酸溶液中的氢离子浓度相同恰好反应,氨水又电离出铵根离子和氢氧根离子.D、pH=11的氨水和pH=11的NaOH溶液中氢氧根离子浓度相同,碱的浓度不同.
B、pH=3的CH3COOH溶液中酸部分电离,酸的浓度大于0.001mol/L,pH=11的NaOH溶液中氢氧化钠完全电离,碱的浓度为0.001mol/L;
C、pH=11的氨水与pH=3的盐酸溶液等体积混合,氨水平衡状态下的氢氧根离子浓度和盐酸溶液中的氢离子浓度相同恰好反应,氨水又电离出铵根离子和氢氧根离子.D、pH=11的氨水和pH=11的NaOH溶液中氢氧根离子浓度相同,碱的浓度不同.
解答:
解:A、pH=3的CH3COOH溶液和pH=3的HCl溶液中c(H+)都等于10-3mol/L,故A正确;
B、pH=3的CH3COOH溶液中酸部分电离,酸的浓度大于0.001mol/L,pH=11的NaOH溶液中氢氧化钠完全电离,碱的浓度为0.001mol/L,所以混合后酸有剩余,所以c(CH3COO-)>c(Na+),故B错误;
C、pH=11的氨水与pH=3的盐酸溶液等体积混合,氨水平衡状态下的氢氧根离子浓度和盐酸溶液中的氢离子浓度相同恰好反应,氨水又电离出铵根离子和氢氧根离子,所以氨水有剩余,所以溶液pH大于7,故C错误;
D、pH=11的氨水和pH=11的NaOH溶液中氢氧根离子浓度相同,碱的浓度不同,氨水中一水合氨部分电离,所以氨水浓度大消耗的盐酸的量多,故D错误;
故选A.
B、pH=3的CH3COOH溶液中酸部分电离,酸的浓度大于0.001mol/L,pH=11的NaOH溶液中氢氧化钠完全电离,碱的浓度为0.001mol/L,所以混合后酸有剩余,所以c(CH3COO-)>c(Na+),故B错误;
C、pH=11的氨水与pH=3的盐酸溶液等体积混合,氨水平衡状态下的氢氧根离子浓度和盐酸溶液中的氢离子浓度相同恰好反应,氨水又电离出铵根离子和氢氧根离子,所以氨水有剩余,所以溶液pH大于7,故C错误;
D、pH=11的氨水和pH=11的NaOH溶液中氢氧根离子浓度相同,碱的浓度不同,氨水中一水合氨部分电离,所以氨水浓度大消耗的盐酸的量多,故D错误;
故选A.
点评:本题考查了弱电解质溶液中的电离平衡应用,主要是强酸、弱酸、强碱、弱碱溶液稀释、pH的大小比较,弱电解质电离平衡的移动的判断.

练习册系列答案
相关题目
下列关于稀有气体的叙述不正确的是( )
| A、各原子轨道电子均已填满 |
| B、其原子与同周期ⅠA、ⅡA族阳离子具有相同的核外电子排布 |
| C、化学性质非常不活泼 |
| D、同周期中第一电离能最大 |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、0.1mol/L NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(HCO3-)+c(CO32-) |
| B、一定量(NH4)2SO4与NH3?H2O混合所得的酸性溶液中:c(NH4+)=2c(SO42-) |
| C、将0.2mol/L CH3COOH溶液和0.1mol/L NaOH溶液等体积混合,则反应后的混合液中:c(OH-)+c(CH3COO-)=c(H+)+c(Na+) |
| D、物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中,c(NH4+)的大小关系:①>②>③ |
下列性质不是由氢键引起的( )
| A、水的熔点比硫化氢高 |
| B、H-F的键能很大 |
| C、乙醇与水能以任意比例混溶 |
| D、冰的密度比水小 |
有两种气态饱和烃的混合物1L,完全燃烧可得同温同压下的3.6L二氧化碳和3.6L水蒸气,这两种烃可能是( )
| A、C2H4、C4H6 |
| B、C2H4、C4H8 |
| C、C3H8、C4H8 |
| D、C3H4、C3H6 |
用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A、1mol硝基(-NO2)与NA个二氧化氮气体分子所含电子数相等 |
| B、1mol氢氧根离子(OH-)与NA个羟基(-OH)所含电子数相等 |
| C、在相同温度下,pH=1且体积为1L的硫酸溶液所含氢离子数与pH=13且体积为1L的氢氧化钠溶液所含氢氧根离子数一定均为0.1NA |
| D、在反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑中,每生成1molO2该反应共转移的电子数为6NA |
25℃时,amol/L稀盐酸与bmoL/L稀氢氧化钠溶液等体积混合后,所得溶液的pH=12(混合液的总体积可视为原两种溶液体积相加),则a和b的关系为( )
A、a=
| ||
| B、b=a+0.02 | ||
| C、a=b+0.02 | ||
| D、a=b+0.01 |
在2L的密闭容器中进行如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),有如下数据:
下列说法正确的是( )
| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | |||
| CO | H2O | CO2 | H2 | CO2 | ||
| 1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
| 2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
| A、正反应为吸热反应 | ||
| B、实验1中,CO的转化率为80% | ||
C、650℃时,化学平衡常数K=
| ||
| D、实验1再加入1.0 mol H2O,重新达到平衡时,n(CO2)为1.6 mol |
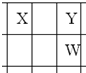 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示.下列说法正确的是( )| A、五种元素中,原子半径最大的是W |
| B、Y的简单阴离子比W的简单阴离子还原性强 |
| C、Y与Z形成的化合物都可以和盐酸反应 |
| D、X与Q形成的化合物是离子化合物 |